Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
AdsorptionAls Adsorption bezeichnet man die Anlagerung der Atome oder Moleküle von Flüssigkeiten oder Gasen an eine feste Oberfläche. Der Begriff stammt vom lateinischen „adsorptio“, bzw. „adsorbere“ = „(an-)saugen“. Der Oberbegriff für Anlagerungsvorgänge lautet Sorption. Das Gegenteil der Adsorption, die Abgabe eines adsorbierten Stoffs, wird Desorption genannt. Als Absorption bezeichnet man die Diffusion von Stoffen in das Innere eines Festkörpers oder einer Flüssigkeit. Weiteres empfehlenswertes Fachwissen
TerminologieDie an der Adsorption und ihrer Umkehrung beteiligten Stoffe werden folgendermaßen bezeichnet:
AnwendungenAls Adsorbenzien kommen beispielsweise Aktivkohle oder Molekularsiebe (Zeolithe) in Form von Schüttungen oder in strukturierter Form zum Einsatz. Die Einlagerung von Stoffen in Filtern wird oft fälschlich als Adsorption oder Absorption bezeichnet. Filter mit tatsächlich adsorptiven Eigenschaften sind z. B. einige Innenraum- oder Kabinenluftfilter. In dieser Filterklasse tragen die Fliter eine Aktivkohleschicht. Diese Funktionsschicht adsorbiert viele gasförmige Stoffe. Technisch wird die Adsorption in der Filtertechnik zur Vermeidung oder Behebung von Verunreinigungen benutzt. Dabei kommt es auf eine möglichst hohe Adsorptionsfähigkeit der Filteroberfläche an. Ein weiteres Anwendungsgebiet ist die Trennung und Feinreinigung von Gasgemischen. Dabei macht man sich den Effekt zunutze, dass sich die betreffenden Gase druck- und temperaturabhängig unterschiedlich stark an der Oberfläche des Adsorbens anlagern; man unterscheidet die Betriebsarten Druckwechsel-Adsorption und Temperaturwechsel-Adsorption. In der Industrie wird so z. B. aus Synthesegas hochreiner Wasserstoff gewonnen. Auch mit Lösungsmitteldämpfen verunreinigte Luft kann so gereinigt werden. In der Wasseraufbereitung, Abwasserreinigung und in der Industriewasserwirtschaft wird die Adsorption zur Entfernung von schädlichen Wasserinhaltsstoffen und zur Stoffrückgewinnung verwendet. Da bei der Adsorption Bindungsenergie freigesetzt und bei der Desorption Energie verbraucht wird, kann eine auf der Adsorption basierende Wärmepumpe, beispielsweise eine Adsorptionskältemaschine, konstruiert werden. OberflächenwissenschaftIn der Oberflächenchemie und Oberflächenphysik unterscheidet man zwischen Physisorption und Chemisorption:
Beide Prozesse sind in der Regel reversibel. Durch die Adsorption auf der Oberfläche können sich die Adsorbate nur noch in einer Fläche bewegen. Dadurch können chemische Reaktionen zwischen Adsorbaten häufiger stattfinden, ein Effekt, der in der heterogenen Katalyse ausgenutzt wird. Festkörper zeichnen sich im Allgemeinen dadurch aus, dass alle Bindungen der Atome bzw. Moleküle gesättigt sind. Bei Kristallen drückt sich dies durch die Koordinationszahl aus, die angibt, wie viele nächste Nachbarn jedes Atom besitzt. Auf der Oberfläche ist diese Symmetrie verletzt, und es sind freie Bindungselektronen (engl. dangling bonds) vorhanden bzw. leichte Ladungsverschiebungen. Neben einer Rekonstruktion der Oberfläche gibt es viele mögliche Bindungsplätze für Adatome. Die genaue Gestaltung des Potenzials der Oberfläche hängt von der elektronischen Struktur ab. Im einfachsten Fall existiert knapp oberhalb der Oberfläche nur ein Potenzialminimum, in dem sich Adatome aufhalten können. Ansonsten kann etwas weiter außerhalb ein Potenzialmaximum liegen, das eine Adsorptionsbarriere darstellt. Fliegt ein Teilchen auf die Oberfläche zu, würde es beim elastischen Stoß ohne Energieverlust immer reflektiert und es würde nie zu einer Adsorption kommen. Stattdessen führen zwei Mechanismen zu einer Adsorption des Teilchens aus der Gasphase auf der Oberfläche:
Weiterhin kann eine Adsorption über so genannte Precursor stattfinden: Auf der Oberfläche sitzt bereits ein anderes Teilchen B, an das zuerst das ankommende Teilchen A bindet, um dann zur Oberfläche zu diffundieren. AdsorptionsrateDie Adsorptionsrate bezeichnet die Rate, mit der Teilchen auf der Oberfläche adsorbiert werden. Da sich zwischen Adsorbaten und der Gasphase (oder Flüssigkeitsphase) ein Gleichgewicht aufbaut, ist die Adsorptionsrate immer im Zusammenhang mit der Desorptionsrate zu sehen. Die einfachste mathematische Beschreibung der Adsorptionsrate beinhaltet nur zwei Faktoren:
Dabei bedeuten:
Abhängig von den genauen Details, die betrachtet werden sollen, werden beide Glieder unterschiedlich behandelt. Für die Teilchenrate lässt sich allgemein sagen, dass sie von dem Druck und der Temperatur abhängt: In einer anderen Darstellung (Umformulierung), kommt der reale Zusammenhang mit der Temperatur besser zur Geltung: Der Haftkoeffizient hängt dagegen sehr stark von dem untersuchten Objekt ab. In diesen können zum Beispiel Struktur der Oberfläche oder auch Bedeckungsgrad der Oberfläche eingehen. Die Adsorption von Teilchen an Stufen oder Eckatomen unterscheidet sich teilweise sehr stark von einer Adsorption direkt auf einer Terrassenfläche: Wobei gilt:
Die Aktivierungsenergie EA ist nicht zu verwechseln mit der Adsorptionsenergie, die frei wird, wenn das Adsorbat an der Oberfläche gebunden wird. Die Aktivierungsenergie resultiert aus den Veränderungen am Adsorbat, die für eine Adsorption notwendig sind. Während einige Adsorbate (z. B. H2 oder O2) zunächst dissoziieren, müssen andere Adsorbate (z. B. CO2) ihre räumliche Konfiguration ändern (Relaxation). Grundlegende Abhängigkeiten der Adsorption lassen sich wie folgt beschreiben:
AdsorptionsisothermeIst das System Gas / Oberfläche reversibel, so liegt ein Zusammenhang zwischen dem Partialdruck des Gases und der Bedeckung der Oberfläche vor:
Dabei bedeutet θ die Bedeckung der Oberfläche und f(p,T) eine Funktion von Druck und Temperatur. Für Rechnungen werden bevorzugt Adsorptionsisothermen verwendet, bei denen die Temperatur konstant gehalten wird:
KinetikZusammen mit der Adsorption sind für kinetische Betrachtungen auch die Desorption und Diffusion zu betrachten. Im Allgemeinen ergibt sich die Kinetik durch ein Ratengleichgewicht zwischen den Raten, die zu einer Population der Oberfläche führen (Adsorption, Diffusion zur Oberfläche), und den Raten, die zu einer Depopulierung der Oberflächen führen (Desorption, Diffusion von der Oberfläche):
Wird die Diffusion vernachlässigt, kann die Kinetik über folgendes Reaktionsgleichgewicht beschrieben werden: Wobei gilt:
Erweitern kann man dieses Modell, indem weiter zwischen einem Adsorbatplatz an Stufen, Eckatomen und auf der Terrasse unterschieden wird. Kondensation/EpitaxieIm speziellen bezeichnet die Adsorption nur die Adsorption der ersten Monolage auf dem Substrat. Ist die erste Monolage vollständig besetzt, können nachfolgende Adsorbate auf dieser ersten Schicht wieder adsorbieren und weitere Monolagen ausbilden. Da die Bindungen hier zwischen den Adsorbaten bestehen, handelt es sich bei dem weiteren Prozess streng genommen um eine Kondensation der Adsorbate. Über die Temperatur lässt sich der Prozess steuern. Die Bindungsenergien der Adsorbate im Kondensat unterscheidet sich von der Bindungsenergie zum Adsorbens, was sich in unterschiedlichen Adsorptionsraten niederschlägt. Analog zur thermisch programmierten Desorption lassen sich unter Kenntnis der einzelnen Desorptionstemperaturen gezielt einzelne Monolagen auf einem Substrat auftragen. Voraussetzung ist nur, dass die Kondensationsenergie (Bindungsenergie der Adsorbate untereinander) deutlich geringer ist als die Adsorptionsenergie zu dem Substrat. Kann das Adsorbat in einer Kristallstruktur auf dem Adsorbens aufwachsen, entsteht durch die Adsorption Lage für Lage ein Kristall (Epitaxie). Literatur
Kategorien: Physikalische Chemie | Trennverfahren | Oberflächenphysik | Verfahrenstechnik |
|
| Dieser Artikel basiert auf dem Artikel Adsorption aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





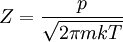
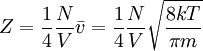
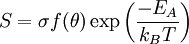
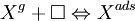
 freier Oberflächenplatz
freier Oberflächenplatz


