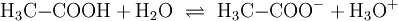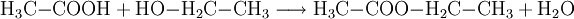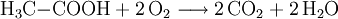Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
AlkansäurenAlkansäuren sind Carbonsäuren, die aus einem Alkylrest und einer Carboxyl-Gruppe aufgebaut sind. Alkansäuren haben die allgemeine Summenformel CnH2n+1COOH (n = 0, 1, 2, 3, ...). Definitionsgemäß verfügt ein Alkylrest weder über aliphatische noch aromatische Doppelbindungen. Verbindungen mit linearen Alkylresten werden auch als gesättigte Carbonsäuren bezeichnet. Alkansäuren mit zwei Carboxyl-Gruppen bezeichnet man als Alkandisäuren und zählt sie zu den Dicarbonsäuren. Die einfachste Alkansäure ist die Methansäure, die unter dem Trivialnamen Ameisensäure bekannt ist. Viele Alkansäuren ab der Butansäure (Buttersäure) zählen zu den gesättigten Fettsäuren. Weiteres empfehlenswertes Fachwissen
Aufbau von AlkansäurenAlkansäuren bestehen aus der Carboxylgruppe und dem aliphatischen Alkylrest:
EigenschaftenDie kürzerkettigen Alkansäuren, insbesondere Butansäure, sind stark übelriechende Flüssigkeiten und reagieren in Wasser sauer. Längerkettige Alkansäuren sind bei Zimmertemperatur weiße Feststoffe. Aufgrund des polaren Charakters der Carboxylgruppe sind die Alkansäuren in der Lage, Wasserstoffbrückenbindungen auszubilden, weswegen sie eine erhöhte Siedetemperatur aufweisen. All diese Eigenschaften nehmen mit ansteigender Kettenlänge ab, da dann der Einfluss der Carboxylgruppe auf das Gesamtmolekül abnimmt. ReaktionenDissoziationIn Wasser dissoziieren kürzerkettige Alkansäuren (hier Essigsäure): Das entstehende Säurerest-Ion wird benannt nach dem am Aufbau der Säure beteiligten Alkan und „-oat“ angehängt (teilweise findet sich auch die Endung „-at“), also beispielsweise: Ethan + „-oat“ : Ethanoat-Ion (auch Acetat-Ion) Allerdings dissoziieren Alkansäuren nicht vollständig, d. h. nur ein Teil der Alkansäuremoleküle geben ein Wasserstoffion ab. In der Regel sind Alkansäuren also schwache Säuren, was sich in der Säurestärke ausdrückt. VeresterungErwärmt man ein Gemisch aus einer Alkansäure und einem Alkohol im Wasserbad, so findet eine Veresterung statt. Dabei reagiert die OH-Gruppe des Alkohols mit der COOH-Gruppe der Alkansäure und es wird unter Abspaltung von Wasser ein Ester gebildet:
vollständige OxidationAlkansäuren werden bei der Verbrennung zu Kohlenstoffdioxid und Wasser oxidiert:
Ist das Sauerstoff-Angebot in der Luft nicht ausreichend, entstehen statt Kohlenstoffdioxid Kohlenstoffmonoxid oder Kohlenstoff (in Form von Ruß). Namen und Formeln von Alkansäuren
Weitere Fettsäuren sind die Palmitinsäure (Hexadecansäure, C15H31COOH) und die Stearinsäure (Octadecansäure, C17H35COOH). Quellen
Kategorien: Stoffgruppe | Alkansäure |
|||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Alkansäuren aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |