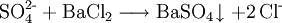Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Ammoniumcarbonatgruppe
Die Ammoniumcarbonat-Gruppe ((NH4)2CO3-Gruppe) ist Bestandteil des Kationentrenngangs, einem klassischen Verfahren der qualitativen Analyse in der Anorganischen Chemie. Diese Kationengruppe fällt dort aus dem Filtrat der im Trennungsgang vorausgegangenen Ammoniumsulfidgruppe aus, wenn diese mit dem Trennmittel konzentrierte Ammoniumcarbonat-Lösung versetzt wird. Zur Ammoniumcarbonat-Gruppe gehören diejenigen Elemente, die mit dem Trennmittel schwerlösliche Carbonate bilden (Fällungsreaktion); Beispiel:
Der Ausfällung der Erdalkalimetall-Kationen folgt deren Auftrennung, um sie anschließend - ungestört von Kationen wie Magnesium - mithilfe von Nachweisreaktionen auffinden zu können. Die so ausgefällten Carbonate können zur Auftrennung in Säuren gelöst werden: 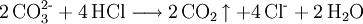 Überschüssiges Fällungsmitel ((NH4)2CO3) zerfällt beim Sieden in die Gase, aus denen es industriell hergestellt wird: Im Folgenden wird kurz der vereinfachte Standardtrennungsgang beschrieben. Weiteres empfehlenswertes Fachwissen
Verfahren1. Schritt: Die Gruppenfällung mit AmmoniumcarbonatlösungFiltrat der Ammoniumsulfidgruppe mit HCl ansäuern und Schwefelwasserstoff verkochen; aus nicht allzu verdünnter Lösung (gegf. Volumen durch Sieden auf einige mL einengen) im ammoniakalischen mit einem Überschuss an konzentrierter Ammoniumcarbonatlösung ausfällen. Bei einem pH-Wert von 8 bis 9 fallen in (NH4)2CO3-haltiger Lösung die Carbonate von Ca(II), Sr(II) und Ba(II) mit Carbonat-Anionen. Filtrat auf Vollständigkeit der Fällung prüfen und den Niederschlag mit Ammoniumcarbonatlösung waschen. 2. Schritt: Abtrennung des BariumsCarbonatniederschläge in 1-2 mL 2molarer Essigsäure (HAc) lösen und das Kohlendioxid durch Kochen vertreiben, mit 2-3 Spatelspitzen Salmiaksalz abpuffern und tropfenweise orange Dichromatlösung 3.Schritt: Untersuchung auf Strontium und CalciumDas Filtrat der Bariumchromatfällung wird mit 1 mL konzentrierter Ammoniumcarbonatlösung gekocht (ca. 1 min), filtriert und der Niederschlag wird chromatfrei gewaschen und danach in 5m HCl gelöst. Das Kohlendioxid wird verkocht und die Lösung geviertelt (1:2:1):
Weitere Flammenfärbungen: Barium, fahlgrün Literatur
Kategorien: Nachweisreaktion | Chemisches Analyseverfahren |
|
| Dieser Artikel basiert auf dem Artikel Ammoniumcarbonatgruppe aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |


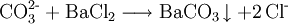 Dies sind neben
Dies sind neben 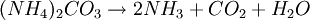



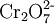 zugeben, bis dass gelbes Bariumchromat ausfällt und überstehende Lösung durch
zugeben, bis dass gelbes Bariumchromat ausfällt und überstehende Lösung durch