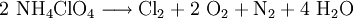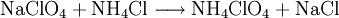Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Ammoniumperchlorat
Ammoniumperchlorat, NH4ClO4, ist das Salz der Perchlorsäure HClO4 mit Ammoniak NH3. Oft hergestellt durch Einwirken von Perchlorsäure HClO4 auf Ammoniumchlorid NH4Cl. Weiteres empfehlenswertes Fachwissen
EigenschaftenAmmoniumperchlorat, Summenformel NH4ClO4, bildet farb- und geruchlose, leicht wasserlösliche Kristalle, die bei Reibung, Hitze und in Gegenwart starker Säuren explodieren können. Feuergefahr besteht bei Berührung mit brennbaren Stoffen oder Reduktionsmitteln wie Schwefel, Phosphor, Metallpulver und organischen Stoffen. Bei Kontakt treten starke Reizungen an den Schleimhäuten auf. Der Umgang mit Ammoniumperchlorat ist im Sprengstoffgesetz geregelt und in Deutschland ohne entsprechende Erlaubnis verboten. Chemische Eigenschaften (bei Standardbedingungen):
VerwendungAmmoniumperchlorat eignet sich mit einem Bindemittel versetzt als Raketentreibstoff für Feststoffraketen, Feuerwerksraketen, Modellraketen oder als Sprengstoff. Der Grund dafür ist, dass sich Ammoniumperchlorat bei Initialzündung oder Erhitzung über 200 °C nach folgender Gleichung zersetzt:
Es entstehen außer Wasser nur gasförmige Reaktionsprodukte, die sich wegen der entstehenden Reaktionswärme explosionsartig ausdehnen. Das Ammonium-Ion wirkt als Reduktionsmittel, das Perchlorat-Anion als Oxidationsmittel. Der freigesetzte Sauerstoff und das Chlor können noch weiter oxidierend wirken, daher wird noch bis zu 30 Massenprozent Aluminium zugesetzt, das dann als eigentlicher Treibstoff dient, und mit seiner hohen Reaktionstemperatur die Reaktion zwischen den Bestandteilen des Ammonimperchlorats in Gang hält. Der spezifische Impuls ist aber trotzdem geringer als bei den meisten Flüssigtreibstoffen, trotzdem wird und wurde Ammoniumperchlorat in Gemisch mit anderen brennbaren Substanzen (besonders Aluminiumpulver) für Raketenbooster eingesetzt, da diese einfach und billig in der Konstruktion sind, beispielsweise für Ariane 5, Titan IIIC-IVB, H-II,- und Delta-Raketen. Eine weitere Verwendung findet es in Blinksternen (Strobestars) die gelegentlich auf Großfeuerwerken eingebaut in Feuerwerksbomben verschossen werden. HerstellungDie industrielle Herstellung erfolgt elektrolytisch in der sogenannten Perchloratzelle. Dabei wird zunächst das Salz Natriumchlorid NaCl in einer wässrige Lösung zum Salz Natriumperchlorat NaClO4 oxidiert. Anschließend wird das Natriumperchlorat mit einem Ammoniumsalz (zum Beispiel Ammoniumchlorid NH4Cl) in einer Ionentauschreaktion umgesetzt. Dabei entsteht das Endprodukt:
Durch die verschiedenen Löslichkeiten der Salze lassen sich diese leicht trennen. Das entstandene Natriumchlorid NaCl lässt sich wiederum als Ausgangsprodukt für die Perchloratzelle verwenden. GefährlichkeitDas unkontrollierte Abbrennen von Ammoniumperchlorat ist sehr gefährlich. Am 4. Mai 1988 ereignete sich in Henderson, Nevada ein verheerender Brand in einer Fabrik, die das Ammoniumperchlorat für den Raketentreibstoff der NASA hergestellt hat. Hierbei gab es eine Explosion, die mehr als 25 Meilen weit zu spüren war. Video der Katastrophe Kategorien: Explosionsgefährlicher Stoff | Reizender Stoff | Ammoniumverbindung | Perchlorat |
||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Ammoniumperchlorat aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||