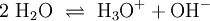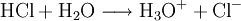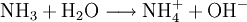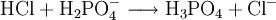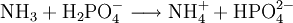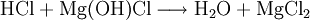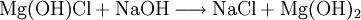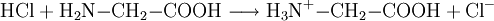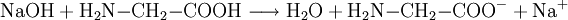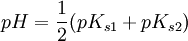Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
AmpholytAmpholyte (zusammengesetzt aus griechisch αμφίς (amphis) = auf beiden Seiten und λύσις (lysis) = Auflösung) beziehungsweise amphotere oder amphiprotische Verbindungen sind chemische Verbindungen, die sowohl als Brønsted-Säure als auch als Brønsted-Base reagieren können. Dieses Verhalten bezeichnet man auch als Säure-Base-Amphoterie. Weiteres empfehlenswertes Fachwissen
EigenschaftenWie auch bei allen Säuren und Basen ist die Löslichkeit der Ampholyte in Wasser stark vom pH-Wert abhängig. Manche Ampholyte reagieren mit sich selbst. Das bekannteste Beispiel dafür ist Wasser. Wasser kann z. B. zu H3O+ oder zu OH− reagieren, je nachdem, was es für einen Reaktionspartner bekommt. Das Verhalten von Wasser mit sich selbst zu reagieren wird auch als Autoprotolyse bezeichnet. Beispiele für AmpholyteVerbindungen, die zur Autoprotolyse neigenBeispiele:
Reaktionsbeispiel: Wasser Reagiert mit Säure als Base: Reagiert mit Base als Säure: Teilweise deprotonierte mehrbasige SäurenBeispiele:
Reaktionsbeispiel: Dihydrogenphosphat Reagiert mit Säure als Base: Reagiert mit Base als Säure: Teilweise protonierte mehrbasige BasenBeispiele:
Reaktionsbeispiel: basisches Magnesiumchlorid Reagiert mit Säure als Base: Reagiert mit Base als Säure: Verbindungen mit sauren und basischen funktionellen GruppenHierunter fallen alle Verbindungen, die mindestens eine saure und mindestens eine basische Gruppe besitzen. Es können natürlich auch mehrere saure und basische Gruppen sein. Beispiele:
Reaktionsbeispiel: Glycin (einfachste Aminosäure) Reagiert mit Säure als Base: Reagiert mit Base als Säure:
Berechnen des Eigen-pH-Werts von AmpholytenLöst man Ampholyte (mit zwei funktionellen Gruppen) in Wasser so stellt sich ein mittlerer pH-Wert ein, der sich mit folgender (Konzentration unabhängigen) Näherungsformel berechnen lässt: Dabei sind pKs1 und pKs2 die Säurekonstanten (pKs-Werte) des Ampholyten. Bei diesem pH-Wert haben Ampholyte die niedrigste Löslichkeit. Die Löslichkeit nimmt sowohl mit steigendem als auch mit fallendem pH-Wert zu. Außerdem erscheint der Ampholyt bei diesem pH-Wert „elektrisch neutral“, was man bei der isoelektrischen Fokussierung ausnutzt. Siehe auchKategorien: Chemikaliengruppe | Säure-Base-Reaktion |
|
| Dieser Artikel basiert auf dem Artikel Ampholyt aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |