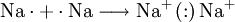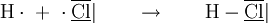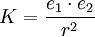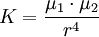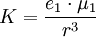Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Chemische BindungChemische Bindung ist die Bezeichnung für den Zusammenhalt der kleinsten Teilchen in chemischen Stoffen. Die kleinsten Teilchen können Atome, Anionen, Kationen oder Moleküle sein. Durch Lösen und Knüpfen von chemischen Bindungen in einer chemischen Reaktion werden Stoffe ineinander umgebaut. Die Produkte können völlig andere Eigenschaften als die Ausgangsstoffe besitzen. Weiteres empfehlenswertes Fachwissen
Starke Bindungen
Oktettregel und Wertigkeit der ElementeWalther Kossel (1915) und Gilbert Newton Lewis (1916) entwickelten die Oktettregel zur Erklärung der Zahlenverhältnisse der Elemente in chemischen Bindungen. Demnach sind die Elementatome bestrebt, durch chemische Bindung die im Periodensystem nächst gelegene Edelgas-Konfiguration zu erreichen, indem sie die entsprechende Zahl an Elektronen abgeben oder aufnehmen. Die bestimmende Eigenschaft ist somit die Wertigkeit der Elemente. Beispiele:
Die Bezeichnung Oktettregel leitet sich von den acht Valenzelektronen der Edelgase ab. Diese Regel gilt allerdings nur in der 1. und 2. Periode der Hauptgruppenelemente ohne Einschränkung. Bei den Hauptgruppenelementen der übrigen Perioden können auch andere Konfigurationen erreicht werden. So hat der Schwefel in der Schwefelsäure 12 Valenzelektronen (Diese Annahme gilt jedoch nur in erster Näherung. Nach modernen Berechnungen und in der MO-Theorie wird das Elektronenoktett nicht überschritten! Die Bindung erhält stattdessen teilweise ionischen Charakter.). Die Nebengruppenelemente erreichen zuweilen andere, relativ stabile Konfigurationen. Metallcharakter im PeriodensystemInnerhalb einer Periode nimmt der Metallcharakter der Atome im Periodensystem von links nach rechts ab und von oben nach unten zu. Entsprechend findet man fließende Übergänge zwischen den drei Bindungsarten, an welchen Metalle und Nichtmetalle beteiligt sind. Für den Ionencharakter gilt das gleiche Prinzip in umgekehrter Richtung. Hierzu einige Beispiele aus der 3. Periode:
Innerhalb der Verbindungen des Chlors mit den Elementen der 3. Periode des Periodensystems nimmt der Ionencharakter der Bindungen immer mehr ab und der kovalente Charakter zu.
Entsprechend der Oktettregel kommt eine chemische Bindung formal dadurch zustande, dass Nichtmetallatome als Bindungspartner Elektronen aufnehmen und Metalle Elektronen abgeben. Man bezeichnet dies als Donator-Akzeptor-Prinzip. IonenbindungEine Ionenbindung wird zwischen Metall- und Nichtmetallatom dadurch ausgebildet, dass das Metallatom seine Valenzelektronen vollständig an das Nichtmetallatom abgibt. Dadurch entsteht aus dem Metallatom ein Kation und aus dem Nichtmetallatom ein Anion. Aufgrund der elektrostatischen Anziehung zwischen diesen Ionen entsteht ein Ionengitter. Gitter bilden sich nur im festen Zustand aus. Im flüssigen Zustand bricht das Gitter zusammen, die Teilchen sind leichter gegeneinander verschiebbar, der Bindungscharakter bleibt aber erhalten. Ionische Verbindungen haben auf Grund der hohen elektrischen Anziehungskräfte zwischen ihren Teilchen salzartigen Charakter: Sie weisen hohe Schmelztemperaturen auf, leiten den elektrischen Strom nur in Schmelze und Lösung (Leiter 2. Ordnung, Elektrolyte) und sind sehr spröde. Beispiel: Formale Bindungsbildung von Kaliumiodid MetallbindungDa bei einer Metallbindung alle Bindungspartner Metalle sind, geben auch alle Atome Valenzelektronen ab. Die dadurch entstandenen Metallkationen werden durch die jetzt frei beweglichen Elektronen (das sog. Elektronengas) zusammengehalten, es entsteht ein Metallgitter. Im Gegensatz zur Ionenbindung bildet sich das Gitter bei einer Metallbindung verschiedener Elemente im Allgemeinen nicht stöchiometrisch aus. Metalle sind daher allesamt elektrisch leitfähig (Leiter 1. Ordnung), gut verformbar (duktil), gute Wärmeleiter und von metallischem Glanz (vgl. Abbildung Kupfer). Beispiel: Formale Bindungsbildung von Natrium als Metallgitter AtombindungDa bei einer Atombindung (auch Kovalenzbindung, kovalente Bindung oder Elektronenpaarbindung) alle Bindungspartner Nichtmetalle sind, nehmen auch alle Atome Valenzelektronen auf. Dadurch entstehen Moleküle oder Atomgitter, die durch bindende Elektronenpaare zusammengehalten werden. Die Elektronen befinden sich in sogenannten Molekülorbitalen (MO) zwischen beiden Bindungspartnern (bindende Elektronenpaare), der so gebildete Atomverband wird Molekül genannt. Deshalb spricht man von einer molekularen oder kovalenten Bindung (von lat. valens, von Wert sein – vgl. Wertigkeit (Chemie)), auch Elektronenpaarbindung oder Atombindung genannt. Diese kann polar oder unpolar sein, je nachdem, ob die Elektronen im Molekül symmetrisch oder asymmetrisch verteilt sind. Molekulare Stoffe weisen zumeist niedrige Siedetemperaturen auf, sind elektrische Nichtleiter (Isolatoren) und liegen entweder in flüchtiger Form vor (kleine Moleküle, Beispiel: Wasser, Sauerstoff, Chlorwasserstoff) oder kunststoff- und diamantartig (Riesenmoleküle, Polymere, Beispiel: Polyethylen, Stärke, Bornitrid). Beispiel: formale Bindungsbildung bei Chlorwasserstoff Schwache BindungenSchwache Bindungen (Synonym: Van-der-Waals-Wechselwirkung im weiteren Sinne) bilden sich in der Regel zwischen Molekülen aus und beeinflussen die spezifischen physikalischen Eigenschaften wie Siede- und Festpunkt. In Makromolekülen (zum Beispiel Polypeptide) treten sie auch als innermolekulare Bindungen auf. Bei sehr schwachen Bindungen wird statt des Begriffs Bindung der Begriff Wechselwirkung oder Zwischenmolekulare Kraft verwendet.
Bei schwachen Bindungen kann kein vollständiger Elektronenübergang oder Ausbildung von bindenden Elektronenpaaren formuliert werden. Hier findet nur eine Verschiebung von negativer Ladung innerhalb eines Moleküls statt, wodurch elektrische Dipole entstehen, die andere Dipole oder Ionen anziehen können (siehe polare Atombindung). In Proteinen können alle Arten der schwachen Wechselwirkung sowie Ionen- und Atombindungen auch innerhalb eines einzigen Polypeptid-Moleküls auftreten. Elektrostatische AnziehungAlle chemischen Bindungen und Wechselwirkungen lassen sich auf elektrostatische Anziehung zwischen entgegengesetzten Ladungen zurückführen.
Räumliche AusrichtungIn Molekülen und Atomgittern ist die räumliche Ausrichtung der Bindungspartner von der Geometrie der Atomorbitale abhängig. (Näheres siehe dazu unter Atombindung.) In Metall- und Ionengittern hängt die räumliche Struktur von der Größe der Bindungspartner ab, die sich auf einer gedachten Kugeloberfläche anordnen. (siehe dazu Kugelpackung, Kristallstruktur). Permanente oder induzierte Dipolmoleküle richten sich zueinander so aus, dass ihre entgegengesetzt geladenen Molekülteile zueinander weisen und die Teile mit gleicher Partialladung einen möglichst großen Abstand voneinander haben. (siehe VSEPR-Modell) BindungslängeDies ist der Abstand der Mittelpunkte der Atome oder Ionen bei chemischen Bindungen. Bei kristallinen Festkörpern mit Ionen- oder Metallgitter lassen sich die Abstände der Gitterbausteine durch Röntgen- oder Elektronenbeugung ermitteln. Da in Kristallgittern unterschiedliche Abstände der Netzebenen gemessen werden können, wird in Tabellen in der Regel der kleinste Abstand als Bindungslänge angegeben. Im Calciumfluorid beträgt der Abstand zwischen den Calciumkationen Ca2+ und den Fluorid-Anionen F− 235 pm (Picometer). In Metallgittern beträgt der Abstand je nach Atomgröße zwischen 200 pm und 500 pm. Zur Atombindung siehe dort Wasserstoffbrückenbindungen weisen je nach Polarisierungsgrad Abstände zwischen 120 pm und 300 pm auf. Bindungsstärke und BindungsenergieEine Bindung ist um so stärker, je mehr Energie bei ihrer Bildung frei wird. Umgekehrt gilt auch: Je stärker eine Bindung ist, um so mehr Energie muss aufgewandt werden, um sie zu lösen und um so weniger reaktiv ist die Verbindung oder das Element. Als Bindungsenergie wird bei Ionenverbindungen die Gitterenthalpie angegeben, das ist die Enthalpie, die aufgewandt werden muss, um einen festen Kristall in die Gasphase zu überführen, in der die Ionen frei beweglich sind. Die Gitterenthalpie hängt einerseits von der Größe der beteiligten Ionen ab: Je größer die Ionen, desto kleiner ist die Gitterenergie, da die Anziehungskräfte mit zunehmender Entfernung der positiven Kerne von der negativen Elektronenhülle des Bindungspartners abnehmen. Beispiele: Gitterenthalpie der Fluoride der Alkalimetalle bei 25 °C in kJ pro mol:
Andererseits hängt die Gitterenergie von der elektrischen Ladung der beteiligten Ionen ab: Je größer die Ladungen, desto größer sind die Anziehungskräfte und um so größer ist die Gitterenergie. Beispiele: Gitterenthalpie bei 25 °C in kJ/mol (in den Beispielen ändert sich der Ionenradius nur wenig):
Die höchste Gitterenthalpie weist Aluminiumoxid Al2O3 (Al3+ und O2−) mit 15157 kJ/mol auf. Für die Anziehungskraft K zwischen zwei entgegengesetzt geladenen Ionen mit der Ladungsmenge e1 und e2 im Abstand r gilt das Coulomb-Gesetz: Als Maß für die Bindungsstärke bei der Metallbindung kann die Schmelztemperatur verwendet werden: Je höher die Schmelztemperatur, desto stärker sind die Bindungskräfte. Diese hängen wieder sowohl vom Abstand der Metallkationen als auch von der Zahl der abgegebenen Elektronen ab: Je mehr Valenzelektronen abgeben werden und je kleiner der Gitterabstand, um so größer sind die Bindungskräfte und damit die Schmelztemperaturen.
Die Bindungsenthalpie der Atombindung ist durch die Enthalpieänderung bei der Dissoziation von Molekülen in ihre Atome in der Gasphase definiert. Sie hängt, wie die Bindungslänge (siehe oben), sowohl von der Größe der gebundenen Atome als auch von der Zahl der bindenden Elektronenpaare ab: Je größer der Radius der Bindungspartner, desto größer ist ihr Abstand und desto kleiner ist die Bindungsenergie. Bei Bindungen zwischen gleichartigen Atomen lässt sich erkennen, dass ihr Abstand auch von der Zahl der bindenden Elektronenpaare abhängt:
Für delokalisierte Atombindungen gilt entsprechend, dass sie energieärmer als eine Mehrfachbindung, aber energiereicher als eine Einfachbindung sind. So beträgt die Bindungsenthalpie im Benzol 147 kJ/mol.
Bei der Wasserstoffbrückenbindung beträgt die Bindungsenthalpie bei starker Polarisierung der Bindungspartner mindestens 40 kJ/mol, bei schwacher Polarisierung höchstens 20 kJ/mol. Sie ist verantwortlich dafür, dass der Siedpunkt von Wasser bei 100 °C liegt, während der Siedepunkt von Schwefelwasserstoff −83 °C beträgt (siehe Siedepunktanomalie) Wasserstoffbrückenbindungen sind in der Regel zwischenmolekulare Wechselwirkungen. In Eis liegt unterhalb 0 °C ein Molekülgitter vor, ebenso in Zucker (Saccharose) bei Zimmertemperatur (Kristallzucker). Dipol-Dipol-Wechselwirkungen treten zwischen polaren Molekülen auf, die nicht die Bedingungen für eine Wasserstoffbrückenbindung erfüllen. Beispiel: Ether: H3C-O-CH3. Die Stärke der Dipol-Dipol-Wechselwirkung ergibt sich aus der Formel
Dipol-Ion-Wechselwirkungen treten unter anderem beim Auflösen von Salzen in Wasser auf. Dabei umgeben die Wasserdipole die Ionen als Hydrathülle und verhindern dadurch, dass sich Kationen und Anionen wieder zu einem Gitterverband zusammenfügen. Die Stärke der Ion-Dipol-Wechselwirkung ergibt sich aus der Formel
Van-der-Waals-Wechselwirkungen entsteht zwischen unpolaren Molekülen, die sich bei Annäherung gegenseitig polarisieren, es entstehen induzierte Dipole (im Gegensatz zu den permanenten Dipol-Molekülen wie Wasser und Schwefelwasserstoff). Beispiel: Atomverbände in flüssigen Edelgasen, Molekülgitter des Iods bei Zimmertemperatur, π-Komplex bei der Bromierung des Ethens. Die Bindungsenthalpie der Van-der-Waals-Wechselwirkung liegt bei einer Größenordnung von 1 kJ/mol. Ihr Betrag hängt vom Dipolmoment der Teilchen ab. Da es sich aber hier um induzierte Dipole handelt, spielt auch die Polarisierbarkeit der zunächst unpolaren Atome eine Rolle: Große „weiche“ Atome lassen sich leichter polarisieren als kleine „harte“. (Die Definitionen „hart“ und „weich“ sind hier aus dem HSAB-Konzept entnommen.) Dies lässt sich an den Siedepunkten der Edelgase ablesen, die mit zunehmender Größe zunehmend stärkere Van-der-Waals-Wechselwirkungen ausbilden und damit zunehmend mehr Energie benötigen, um diese Anziehungskräfte zu überwinden und in die Gasphase überzutreten.
Die Siedepunkte unpolarer Moleküle hängen allerdings auch von der Oberfläche ab, mit der sie zu benachbarten Molekülen Van-der-Waals-Wechselwirkungen ausüben können. So beträgt der Siedepunkt des linearen, unverzweigten n-Pentans 36,1 °C, während das isomere 2,2-Dimethyl-propan mit der selben molaren Masse einen Siedepunkt von 9,5 °C hat, da es nahezu kugelförmig ist und damit eine geringere „Berührungsfläche“ zu Nachbarmolekülen hat. Chemisorption und PhysisorptionBei geringen Bindungsenergien, die hauptsächlich durch elektrische Anziehungskräfte zustande kommen, spricht man von Physisorption. Zu der Physisorption gehört z. B. die Van-der-Waals-Bindung oder die Wasserstoffbrückenbindung. Bei größeren Bindungsenergien spricht man von Chemisorption, bei der die beteiligten Elektronen-Orbitale überlappen und so zu einer Bindung führen. Zur Chemisorption gehört die kovalente Atombindung und die Komplexbindung. Von Physisorption spricht man bei Bindungsenergien im meV-Bereich, von Chemisorption im eV-Bereich und größer. Eine genaue Grenze zwischen beiden ist oftmals nicht möglich. LiteraturAllgemeine LehrbücherTheorie der chemischen Bindung
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Chemische_Bindung aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |