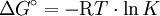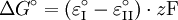Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Chemisches GleichgewichtDas Chemische Gleichgewicht gehört zur Gruppe der dynamischen Gleichgewichte. Grundsätzlich kann sich bei jeder umkehrbaren, d.h. reversiblen, chemischen Reaktionen ein Gleichgewicht einstellen, da bei reversiblen Reaktionen Hin- und Rückreaktion ablaufen können. Chemische Reaktionen, die einen Gleichgewichtszustand einnehmen können, werden auch als Gleichgewichtsreaktionen bezeichnet. Weiteres empfehlenswertes Fachwissen
Der GleichgewichtszustandObwohl Hin- und Rückreaktion beständig ablaufen, also Edukte in Produkte und diese wiederum in Edukte umgewandelt werden, verändern sich im Gleichgewicht die Konzentrationen der Edukte und Produkte nicht. Das Verhältnis der Gleichgewichtskonzentrationen der Edukte und Produkte ist bei einer bestimmten Temperatur konstant und für jede Reaktion charakteristisch. Im Gleichgewicht ist die Geschwindigkeit der Hinreaktion gleich der Geschwindigkeit der Rückreaktion. Das MassenwirkungsgesetzHerleitungDie Geschwindigkeit einer chemischen Reaktion ist direkt proportional zur Aktivität der Edukte: Je höher die Aktivität der Edukte ist, desto schneller läuft die Reaktion ab. Im Verlauf einer Gleichgewichtsreaktion nimmt die Aktivität der Edukte ständig ab. Dadurch verringert sich auch die Geschwindigkeit der Hinreaktion. Gleichzeitig nimmt die Aktivität der Produkte ständig zu. Dadurch vergrößert sich die Geschwindigkeit der Rückreaktion. Sind schließlich beide Reaktionsgeschwindigkeiten gleich, wird in gleichen Zeitspannen ebenso viel Produkt wie Edukt gebildet: Das Gleichgewicht ist erreicht. In der Reaktionsgleichung wird der Gleichgewichtspfeil zur Beschreibung verwendet: Die Geschwindigkeit der chemischen Hinreaktion vhin bzw. der chemischen Rückreaktion Dabei ist khin die Geschwindigkeitskonstante der Hinreaktion und krück ist die Geschwindigkeitskonstante der Rückreaktion. im Gleichgewichtszustand sind die Geschwindigkeiten der Hin- und der Rückreaktion gleich groß: Daraus folgt für die Gleichgewichts- oder Massenwirkungskonstante: Dabei sagt die Gleichgewichtskonstante etwas darüber aus, auf welcher Seite der chemischen Gleichung sich das Gleichgewicht befindet: Eine Zunahme der Gleichgewichtskonstante K bedeutet eine Verschiebung des Gleichgewichts auf die Seite der Produkte, eine Abnahme von K bedeutet eine Verschiebung des Gleichgewichts auf die Seite der Edukte. Zur Erklärung: Haben fast alle Edukte zu Produkten reagiert, so sagt man "das Gleichgewicht liegt bei den Produkten". GleichgewichtslageDie Lage eines Gleichgewichts – und damit die Gleichgewichtskonstante – ist durch die Reaktionsbedingungen Temperatur und Druck festgelegt:
Eine Zunahme der Gleichgewichtskonstante K bedeutet eine Verschiebung des Gleichgewichts auf die Seite der Produkte, eine Abnahme von K bedeutet eine Verschiebung des Gleichgewichts auf die Seite der Edukte. Einfluss eines KatalysatorsEin Katalysator beschleunigt bzw. bremst Hin- und Rückreaktion auf die gleiche Weise. Er verändert damit nicht die Gleichgewichtskonzentrationen der Edukte und Produkte, bewirkt aber, dass sich der Gleichgewichtszustand schneller einstellt. Ein Katalysator setzt die Aktivierungsenergie herauf oder herab. Zudem verlässt er den Vorgang unverändert. Störung des Gleichgewichtes - Prinzip von Le ChatelierWird ein chemisches Gleichgewicht gestört, dann läuft diejenige Reaktion beschleunigt ab, die diese Störung wieder rückgängig macht. Dies nennt man deswegen auch das „Prinzip vom kleinsten Zwang“: Der „Zwang“, der dem Gleichgewicht durch die Störung auferlegt wird, wird durch die beschleunigte Reaktion kompensiert. Störungen sind:
KonzentrationsänderungenZufuhr bzw. Wegnahme eines Reaktionspartners verschiebt das Gleichgewicht in die Richtung, die einen Teil dieser Komponente verbraucht bzw. entstehen lässt. Soll ein Gleichgewicht vollständig zugunsten eines Produkts ablaufen, genügt es, eines der Produkte aus dem Reaktionsgemisch zu entfernen. Dadurch wird die Rückreaktion unterbunden. Verändert man die Konzentration von einem der am Gleichgewicht beteiligten Stoffe, ändern sich die Konzentrationen aller anderen Partner. Da das Gleichgewicht nur von der Temperatur und gegebenenfalls vom Druck abhängt, erfolgt die Änderung mit dem Ziel, das ursprüngliche Gleichgewicht wieder herzustellen. Für eine Gleichgewichtsreaktion: mit lassen sich dabei folgende Fälle unterscheiden:
Beispiele:
Eine Änderung der Reaktionsbedingungen Temperatur und Druck führt zu einer Verschiebung des Gleichgewichts und somit zu einer Änderung der Gleichgewichtskonzentrationen. Zufuhr bzw. Entzug von Wärme / Änderung der TemperaturWärmezufuhr bzw. Wärmeentzug bewirken eine Gleichgewichtsverschiebung, d. h. die Einstellung eines neuen Gleichgewichts mit veränderten Konzentrationen. Wärmeentzug begünstigt die Wärme liefernde (exotherme) Reaktion, Wärmezufuhr die Wärme verbrauchende (endotherme) Reaktion. Dadurch fällt die Temperaturänderung des Systems geringer aus als ohne Gleichgewichtsverschiebung. Eine Temperaturänderung führt immer zu einer Änderung der Gleichgewichtskonzentrationen. Welche Konzentration dabei zunimmt bzw. abnimmt, hängt davon ab, ob die Bildung der Produkte exotherm oder endotherm ist:
Volumenänderung / Änderung des DrucksDas chemische Gleichgewicht von Reaktionen, an denen keine Gase beteiligt sind, wird kaum durch eine von außen bewirkte Volumenänderung beeinflusst. Sind hingegen gasförmige Stoffe beteiligt, wird das Gleichgewicht nur dann beeinflusst, wenn sich die Teilchenzahl in der Gasphase durch die Gleichgewichtsverschiebung ändert. Eine Druckänderung wirkt sich nur in einem geschlossenen System auf das Gleichgewicht aus. Je nach Reaktionsbedingung kann man eine Druckänderung oder eine Volumenänderung feststellen: Das System verringert den durch eine Volumenverkleinerung erzeugten Druck, indem es zugunsten der Seite abläuft, die die geringere Teilchenzahl aufweist und somit das kleinere Volumen benötigt. Dadurch fällt die Druckerhöhung weniger stark aus als wenn die Gase zu keiner Reaktion fähig wären. Entsprechend verschiebt eine Volumenvergrößerung das Gleichgewicht in Richtung größerer Teilchenzahlen. Die Lage des Gleichgewichts kann durch eine Druckerhöhung von außen beeinflusst werden:
Findet die Reaktion in einem offenen System statt, kann das bei der Reaktion entstehende Gas ständig entweichen. Dadurch wird ständig neues Gas produziert, das wiederum entweicht. Diese Störung des Gleichgewichts führt dazu, dass es sich nicht einstellen kann: die Reaktion verläuft vollständig zur Produktseite. Freie EnthalpieJe größer der Unterschied in der Freien Enthalpie ( R = Gaskonstante = 8,31441 J·K-1·mol-1 s. a. Freie Enthalpie für Redoxreaktionen gilt: z = Zahl der ausgetauschten Elektronen Beispiele
Kategorien: Thermodynamik | Chemische Reaktion |
||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Chemisches_Gleichgewicht aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





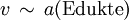
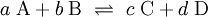
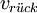 lautet dabei:
lautet dabei:
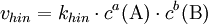
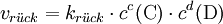
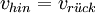
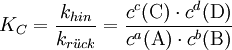
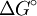 ) zwischen Edukten und Produkten ist, desto mehr liegt das Gleichgewicht auf der Seite mit der niedrigeren Freien Enthalpie. (Cave!
) zwischen Edukten und Produkten ist, desto mehr liegt das Gleichgewicht auf der Seite mit der niedrigeren Freien Enthalpie. (Cave! 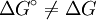 vgl. Standardzustand)
vgl. Standardzustand)