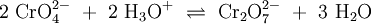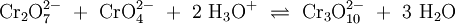Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Chromate
Weiteres empfehlenswertes FachwissenChromate sind Salze der Chromsäure (H2CrO4). Das Chromat-Anion CrO42− hat eine gelbe Farbe und eine tetraedrische Struktur. Das Dichromat-Anion (Cr2O72−) hat eine orange Farbe und ist aus zwei verzerrten, eckenverknüpften Tetraedern aufgebaut. Zwischen Chromaten und Dichromaten besteht in wässrigen Lösungen ein pH-abhängiges chemisches Gleichgewicht: Unter sehr sauren Bedingungen und konzentrierten Lösungen bilden sich in einer analogen Reaktion die eher rötlichen Trichromate (Cr3O102−), Tetrachromate (Cr4O132−) und tiefrote Polychromate (CrnO3n+12−). Alle Chromate sind – besonders unter sauren Bedingungen – starke Oxidationsmittel. VerwendungChromate finden teilweise Verwendung als Korrosionsschutzmittel (Pigmente, siehe auch Rostumwandler). Viele Chromate haben eine intensive Färbung, deshalb werden (oder wurden) sie als farbgebender Bestandteil in Malerfarbe verwendet, beispielsweise „Chromgelb“ (PbCrO4). Chromate finden Verwendung in der analytischen Chemie. Viele Chromate gelten als krebserzeugend, z. B. Zinkchromat, Calciumchromat, Chrom(III)chromat. Siehe auch
Kategorien: Stoffgruppe | Chromat |
|||||
| Dieser Artikel basiert auf dem Artikel Chromate aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |