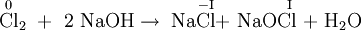Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
DisproportionierungBei der chemischen Reaktion der Disproportionierung, Syn. Dismutation, tritt im Rahmen einer Redoxreaktion ein Element gleichzeitig als Oxidationsmittel und als Reduktionsmittel auf, so dass es vorher in einer mittleren Oxidationsstufe, nachher teils in einer positiveren und teils in einer negativeren Oxidationsstufe vorliegt. Die Atome werden also teils oxidiert, teils reduziert. Weiteres empfehlenswertes FachwissenBeispielChlor reagiert in kalter Natronlauge zu Natriumchlorid, Natriumhypochlorit und Wasser. Dabei wird eines der beiden Chlor-Atome des Chlormoleküls mit der Oxidationszahl 0 zum Chlorid-Ion mit der Oxidationszahl -I reduziert, das andere Chlor-Atom zu der Oxidationsstufe I (Hypochlorit-Ion) oxidiert. In warmer Natronlauge reagiert Natriumhypochlorit weiter zu Natriumchlorat. Siehe auch |
| Dieser Artikel basiert auf dem Artikel Disproportionierung aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |