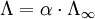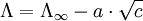Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Elektrolytische LeitfähigkeitDie elektrolytische Leitfähigkeit ist ein Maß für die elektrische Leitfähigkeit in Elektrolytlösungen. Weiteres empfehlenswertes Fachwissen
EinleitungIn einem Elektrolyten bewegen sich Ionen beim Anlegen eines elektrischen Feldes bevorzugt in bzw. gegen die Feldrichtung und verursachen dadurch einen Ladungstransport und Stromfluss. Demzufolge ist eine Abhängigkeit des Stromes I von folgenden Faktoren zu erwarten:
Theoretische HintergründeFür den Elektrizitätstransport innerhalb der Lösung gilt das empirisch gut bestätigte ohmsche Gesetz:
Hierbei sind die geometrischen Faktoren sowie die Beiträge der oben genannten letzten drei Punkte in dem Glied 1 / R, dem Leitvermögen oder reziproken Widerstand, zusammengefasst. Das ohmsche Gesetz ist zur Bestimmung des Leitvermögens 1 / R des Elektrolyten jedoch nur unter Einhaltung gewisser Vorsichtsmaßregeln anwendbar. Zum Anlegen einer Spannung ist der Anschluss an einen äußeren Stromkreis über zwei metallische Leiter (Elektroden) notwendig. Infolge des Stromflusses durch die Grenzfläche Elektrolyt/Elektrode spielen sich nun an dieser Grenzfläche bestimmte Reaktionen ab, welche das Auftreten zusätzlicher Spannungen zur Folge haben. Man bezeichnet diesen Vorgang als Polarisation. Diesen unerwünschten Effekt kann man folgendermaßen umgehen:
Der Widerstand R eines beliebigen Leiters hängt von 2 Parametern ab: dem spezifischen Widerstand ρ (oder Leitfähigkeit 1 / ρ = χ) und einem geometrischen Faktor Z. Bei Elektrolyten wird dieser Faktor Z Zellkonstante genannt. Es gilt dann:
Bei einem gleichförmig stromdurchflossenen, zylindrischen Leiter ist Z = l / q, wobei l die Länge und q der Querschnitt des Leiters sind. Im allgemeinen Fall führt man eine Eichung der Messzelle durch, indem man den Widerstand einer Lösung mit bekanntem χ misst und daraus auf einfache Weise die Zellkonstante erhält. IonentransportDer Ionentransport in Elektrolytlösungen geschieht in folgender Weise: Ein Ion mit der Ladung zie0 erfährt im elektrischen Feld
und setzt sich demzufolge beschleunigt in Bewegung. Infolge der geschwindigkeitsproportionalen hydrodynamischen Reibungskraft geht diese beschleunigte Bewegung aber nach sehr kurzer Anlaufzeit
(10 − 13 s) in eine Bewegung mit stationärer Driftgeschwindigkeit Die auf die Feldstärke 1 V/m bezogene Geschwindigkeit wird die Beweglichkeit ui des Ions genannt.
Aus den Wanderungsgeschwindigkeiten wi erhält man die elektrische Leitfähigkeit χ gemäß folgender Überlegung: Eine Lösung mit N + Kationen und N − Anionen pro cm3 mit den Wertigkeiten z + bzw. z − befinden sich in einem Rohr der Länge l und dem Querschnitt q. Bei Anlegen einer Spannung U an den beiden Enden des Rohres herrscht im Inneren eine Feldstärke
Da ferner nach dem Ohmschen Gesetz gilt:
ergibt sich:
Somit ist die spezifische Leitfähigkeit eindeutig durch Konzentration, Wertigkeit und Wanderungsgeschwindigkeit der einzelnen Ionen festgelegt. Molare WerteEine Umrechnung auf molare Größen unter Berücksichtigung des Zusammenhanges NLe0 = F und das Einführen der
elektrochemischen Wertigkeit ne = v + z − = v − z − ergibt
Der Einfluss des DissoziationsgewichtsBei unvollständiger Dissoziation hängt λ vom Dissoziationsgrad α ab:
Da α bei unendlicher Verdünnung seinen Maximalwert besitzt (α = 1) und mit steigender Konzentration immer kleiner wird, ist ein Absinken der Äquivalentleitfähigkeit ohneweiteres verständlich, was auch bereits frühzeitig erkannt wurde (Ostwaldsches Verdünnungsgesetz).
Der Einfluss der interionischen WechselwirkungskräfteDie Bewegung der Ionen erfolgt nicht frei. Vielmehr tritt infolge der weitreichenden elektrostatischen Kräfte eine gegenseitige Behinderung der wandernden Ionen ein. Ein Ion ist infolge seiner elektrostatischen Wirkung im Mittel von mehr entgegengesetzten als gleichgeladenen Teilchen umgeben. Diese "`Ionenwolke"' ballt sich mit zunehmender Konzentration immer mehr zusammen und hat folgende Wirkungen:
Beide Effekte nehmen mit der Konzentration zu. Die auf diesem Modell aufgebaute Theorie von Debye, Hückel und Onsager liefert für kleine Konzentrationen den Ausdruck:
Dieses Ergebnis wurde bereits viel früher von Kohlrausch experimentell gefunden. Literatur
|
|
| Dieser Artikel basiert auf dem Artikel Elektrolytische_Leitfähigkeit aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





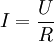
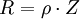
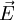 eine Kraft
eine Kraft 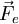 :
:
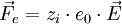
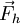 :
:
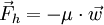
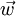 über, so dass
über, so dass 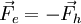 ist. Daraus ergibt sich:
ist. Daraus ergibt sich:
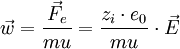
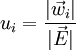 in
in 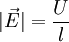 derzufolge sich die Kationen und Anionen in entgegengesetzter Richtung mit den Geschwindigkeiten
derzufolge sich die Kationen und Anionen in entgegengesetzter Richtung mit den Geschwindigkeiten 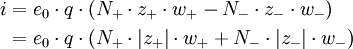
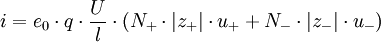
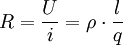
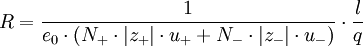 und
und
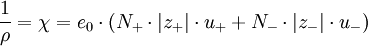
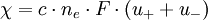 mit
mit 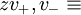 der Anzahl der positiven bzw. negativen Ionen in die ein Molekül dissoziiert;
der Anzahl der positiven bzw. negativen Ionen in die ein Molekül dissoziiert; 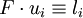 in m
in m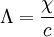 in m
in m