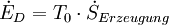Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
ExergieExergie bezeichnet den Anteil der Gesamtenergie eines Systems oder Stoffstroms, der Arbeit verrichten kann, wenn er in das thermodynamische (thermische, mechanische und chemische) Gleichgewicht mit seiner Umgebung gebracht wird. Exergie basiert also auf einem Potential zwischen mindestens 2 Zuständen, wobei einer davon meist der Umgebungszustand ist. Die Exergie ist im Gegensatz zur Energie keine Erhaltungsgröße, d. h. im Gegensatz zur Energie kann Exergie vernichtet werden (siehe Beispiel). Weiteres empfehlenswertes Fachwissen
BeispielBetrachtet man ein System aus energetischer Sicht, so können Exergieverluste zum Beispiel durch einen Wärmetransport an die Umgebung auftreten. Ein Beispiel hierfür wäre ein schlecht isoliertes Warmwasserrohr: Die Energie, die in Form von Wärme verloren geht, kann später nicht mehr genutzt werden, um Arbeit zu leisten. Es gilt aber das Energieerhaltungsprinzip: Das Rohr und die Umgebung zusammen besitzen die gleiche Energiemenge wie vor dem Beginn der Wärmeübertragung. Insofern wäre der Ausdruck "Energieverlust" irreführend. Der zweite Hauptsatz der Thermodynamik (Entropie) ergänzt nun den ersten Hauptsatz der Thermodynamik (Stichwort Energie) bezüglich der möglichen Energieumwandlungen. Werden beispielsweise in einer wärmeisolierten (adiabaten) Mischkammer zwei Stoffe mit verschiedener Temperatur miteinander gemischt, so lassen sich in der Energiebilanzgleichung keine Verluste erkennen, die gesamte Energie im System bleibt gleich. Trotzdem treten thermodynamische Verluste auf, da durch diesen Vorgang Entropie erzeugt wird. Vorher besitzt das System, das die beiden Stoffe enthält, Exergie, da eine Wärmekraftmaschine Arbeit aus dem Temperaturausgleich zwischen den Stoffen ziehen könnte. Nachher ist dies wegen des zweiten Hauptsatzes nicht mehr möglich, es wurde somit Exergie vernichtet. Weitere Beispiele für exergetische Verluste sind zum Beispiel:
AnwendungDas Exergiekonzept liefert ein Werkzeug, mit dem sich zum einen die maximale Nutzarbeit eines Systems oder Stoffstroms berechnen lässt. Zum anderen lassen sich tatsächliche Verluste genau berechnen. Für ingenieurwissenschaftliche Problemstellungen kann es eine Hilfestellung sein, insbesondere wenn das Exergiekonzept mit wirtschaftlichen Größen verknüpft wird - sogenannte thermoökonomische Methoden. In der Literatur liest man häufig den Zusammenhang: wobei Anergie den nicht nutzbaren Teil der Energie kennzeichnet. Dieser Zusammenhang ist jedoch mit Vorsicht zu genießen, insbesondere wenn Prozesse unterhalb der Umgebungstemperatur ablaufen (Kältemaschinen): Unterhalb der Umgebungstemperatur steigt die physikalische Exergie eines Systems mit abnehmender Temperatur, da die Temperaturdifferenz zur Umgebung genutzt werden könnte, um damit eine Wärmekraftmaschine zu betreiben und so Nutzarbeit zu gewinnen. Die innere Energie des Systems sinkt jedoch mit abnehmender Temperatur. Es ist daher bei einem entsprechenden Systemdruck möglich, dass die physikalische Exergie eines Systems unterhalb der Umgebungstemperatur größer ist als seine (innere) Energie, was dann bedeuten würde, dass die Anergie negativ wäre. BerechnungDie Exergie eines Systems oder Stoffstroms setzt sich aus der physikalischen Exergie EPH, der chemischen Exergie ECH, der kinetischen Exergie EKN und der potenziellen Exergie EPT zusammen. Letztere Terme entsprechen der kinetischen und potenziellen Energie: oder massenspezifisch Physikalische Exergie eines SystemsErmitteln lässt sich die physikalischen Exergie EPH eines geschlossenen Systems wie folgt: spezifischer Wert Der spezifische Wert der Exergie ist die durchschnittliche Exergie je Masseneinheit. Absolutwert Der absolute Wert für die Exergie eines Systems ergibt sich aus der Multiplikation des spezifischen Wertes mit der Masse des Systems. Physikalische Exergie eines StoffstromsFür die physikalische Exergie eines Stoffstroms kann folgendermaßen vorgegangen werden: Spezifischer Wert Absoluter Wert wobei der Punkt über der jeweiligen Größe einen Strom kennzeichnet, also zum Beispiel Mit Wärmetransport verbundener ExergietransportHierbei ist Mit Arbeit verbundener ExergietransportWobei der Term In den Berechnungsgleichungen für die Exergie steht u für die massenspezifische innere Energie, h für die massenspezifische Enthalpie, s für die massenspezifische Entropie , p für den Druck, T für die Temperatur, t für die Zeit, v für das massenspezifische Volumen und m für die Masse. Der Index 0 charakterisiert den Zustand des Systems oder Stoffstroms bei Umgebungsdruck und Umgebungstemperatur (im thermischen und mechanischen Gleichgewicht). ExergiebilanzgleichungenDie Exergie eines Systems kann sich durch den Transport von mit Stoff- und Energieströmen verbundenen Exergieströmen über die Systemgrenze oder die Exergievernichtung im System verändern. Die Exergiebilanzgleichung für ein geschlossenes System lautet daher: und für ein offenes System: Die Exergievernichtung Unterschied zwischen Exergie und freier EnthalpieExergie ist nicht mit der Freien Enthalpie G zu verwechseln. Diese ist lediglich eine Zustandsfunktion, die den Zustand eines Stoffes mit bestimmter Zusammensetzung bei gegebener Temperatur und gegebenem Druck beschreibt. Diese ist von der Umgebungsparametern wie Umgebungstemperatur, Druck und z.B. Feuchte unabhängig. Exergie dagegen hängt von Umgebungstemperatur, Druck und Zusammensetzung sehr wohl ab, da sie mechanische Arbeit darstellt, die man in einer geeigneter Maschine gewinnen kann, wenn man diesen Stoff [von gegebenen Temperatur und Druck] bis auf die Umgebungstemperatur und Druck entsprechend abkühlt/anwärmt/entspannt/verdichtet etc. Exergie ist definitiv keine Zustandsfunktion. Die Exergie eines Stoffstromes kann man als Differenz zwischen der freien Enthalpie in gegebenem Zustand und freien Enthalpie bei Umgebungstemperatur und -Druck bestimmen. Literatur
|
|
| Dieser Artikel basiert auf dem Artikel Exergie aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





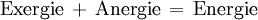
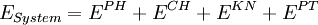
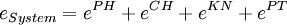
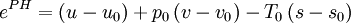
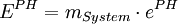
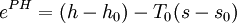
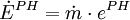
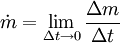
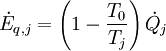
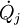 die bei der Systemgrenztemperatur
die bei der Systemgrenztemperatur 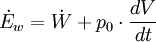
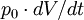 die vom System an der Umgebung oder von der Umgebung am System geleistete Volumenänderungsarbeit kennzeichnet
die vom System an der Umgebung oder von der Umgebung am System geleistete Volumenänderungsarbeit kennzeichnet
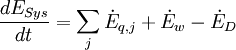
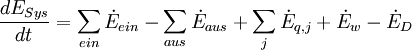
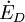 wird durch Irreversibilitäten während des Prozesses hervorgerufen. Der Zusammenhang zwischen der Exergievernichtung und der Entropieerzeugung ist
wird durch Irreversibilitäten während des Prozesses hervorgerufen. Der Zusammenhang zwischen der Exergievernichtung und der Entropieerzeugung ist