Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
GleichgewichtskonstanteDie Gleichgewichtskonstante K, auch Equilibriumskonstante genannt (engl. equilibrium constant), gibt ein Verhältnis von Mengen der bei einer chemischen Reaktion beteiligten Stoffe wieder, für das ein Nettofluss durch die chemische Reaktion energetisch unmöglich wird. Liegen die Edukte und Produkte der Reaktion in dem durch die Gleichgewichtskonstante gegebenen Verhältnis vor, so befindet sich die Reaktion im chemischen Gleichgewicht. Dann findet kein Nettofluss durch die Reaktion statt. Der Fluss durch die Hinreaktion ist gleich dem Fluss durch die Rückreaktion. Weiteres empfehlenswertes FachwissenDie Gleichgewichtskonstante einer Reaktion ist thermodynamisch durch das Verhältnis (Massenwirkungsgesetz) der Konzentrationen der Edukte
definiert (hierfür sind jeweils die Gleichgewichtskonzentrationen zu nehmen), für die die Gibbs-Energie der Reaktion null ist. Hierbei ist c(A) (früher auch [A] geschrieben) die Konzentration des Stoffes A (Stoffmenge von A pro Volumen). Streng genommen ist mit Aktivitäten statt Konzentrationen zu rechnen, bzw. sind die Konzentrationen noch mit Aktivitätskoeffizienten zu multiplizieren. Ist die Gibbs-Energie ΔG einer Reaktion bekannt, lässt sich daraus die Gleichgewichtskonstante berechnen: wobei R die Universelle Gaskonstante, T die Temperatur und e die eulersche Zahl ist. Die Gleichgewichtskonstante macht eine Aussage über die mögliche Richtung und die Energetik einer Reaktion. Sie gibt keinerlei Information über die Geschwindigkeit der Reaktion. Gilt so kann die Nettoreaktion nur in folgender Richtung stattfinden
Gilt so kann die Nettoreaktion nur in folgender Richtung stattfinden
Für gibt es keinen Nettofluss durch die Reaktion (Der Fluss durch die Hin- bzw. Rückreaktion sind dann gleich groß. Sie können, aber müssen nicht Null sein). Deswegen definiert man: als Alternative Kraft. Solange Siehe auch |
| Dieser Artikel basiert auf dem Artikel Gleichgewichtskonstante aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





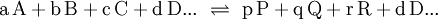
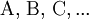 und Produkte
und Produkte 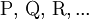
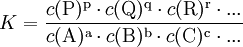 ,
,
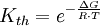
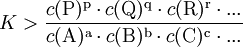
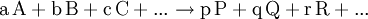 .
.
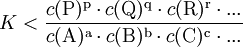
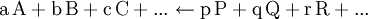 .
.
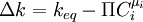
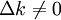 , findet eine Reaktion statt. Ist die Kraft allerdings Null, so befindet sich das System im Gleichgewicht.
Die Gleichgewichtskonstante ist eine Funktion der
, findet eine Reaktion statt. Ist die Kraft allerdings Null, so befindet sich das System im Gleichgewicht.
Die Gleichgewichtskonstante ist eine Funktion der 

