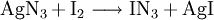Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Iodazid
Iodazid, IN3, ist eine farblose bis gelbe, äußerst explosive, feste Substanz. Formal gehört es zu den Inter-Pseudohalogenen. Iodazid ist nicht zu verwechseln mit dem ebenfalls explosiven Iodstickstoff, NI3. Weiteres empfehlenswertes Fachwissen
Gewinnung und DarstellungIodazid kann durch Reaktion von Silberazid AgN3 mit Iod in einer CFCl3-Lösung gewonnen werden. Da sich Silberazid nur feucht gefahrlos handhaben lässt, Spuren von Wasser aber bereits die Zersetzung des Iodazids bewirken, gelingt dessen Herstellung am besten, wenn vor der Umsetzung mit Iod zur Suspension des Silberazids in Dichlormethan ein Trocknungsmittel gegeben wird. Auf diese Weise erhält man eine reine Lösung von Iodazid, aus der sich beim vorsichtigen Verdampfen des Lösungsmittels nadelförmige, goldglänzende Kristalle isolieren lassen.[5] Zum ersten Mal wurde Iodazid um das Jahr 1900 in sehr unbeständigen etherischen Lösungen und in Form von mit Iod verunreinigten Kristallen durch Reaktion von Iod mit Silberazid erhalten.[6] EigenschaftenDie große Reaktionsfähigkeit von Iodazid bei relativ hoher Stabilität beruht auf der Polarität der I–N-Bindung. Die durch Substitution mit Iodazid eingeführte N3-Gruppe kann wegen ihres hohen Energieinhalts Folgereaktionen eingehen.[5] VerwendungTrotz seiner hohen Brisanz hat Iodazid einige praktische Anwendungen. In der Medizin wird es als Testsubstanz für Vergiftungen mit Disulfiden benutzt.[7] In der chemischen Synthese kann es benutzt werden, um Aldehyde in Carbonsäureazide zu überführen.[8] Literatur
Quellen
Kategorien: Stickstoffverbindung | Iodverbindung |
||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Iodazid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||