Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
IonenstärkeDie Ionenstärke I einer Lösung hat einen entscheidenden Einfluss auf die chemische Aktivität der Ionen in dieser Lösung und ist daher bedeutend für ihre Reaktivität und für die elektrische Leitfähigkeit der Lösung. Weiteres empfehlenswertes FachwissenDie Ionenstärke kann aus den Konzentrationen der Ionen berechnet werden:
mit
Die Ionenstärke ist also gemäß dieser Definition die Hälfte der Summe der mit dem Quadrat der Ladungen der Ionen gewichteten Konzentrationen der einzelnen Ionen. Das bedeutet, dass ein zweifach geladenes Ion im Vergleich zu einem einwertigen Ion den vierfachen Beitrag zur Ionenstärke liefert. BeispieleBei einfach geladenen Ionen ist die Ionenstärke gleich der Salzkonzentration. Für eine Kochsalzlösung mit der Konzentration c(NaCl) = 0,001 mol/l haben beide Ionensorten, Na+ und Cl-, ebenfalls die Konzentration 0,001 mol/l: c(Na+) = 0,001 mol/l und c(Cl-) = 0,001 mol/l). Die Ionenstärke ist wegen z(Na+) = 1 und z(Cl-) = -1: I(NaCl) = 0,5 * ( z2(Na+) * c(Na+) + z2(Cl-) * c(Cl-) ) Bei einem 1:2-wertigen oder 2:1-wertigem Elektrolyten, beispielsweise bei Calciumchlorid, ist die Ionenstärke gleich der dreifachen Salzkonzentration. Beispielsweise gilt für Calciumchlorid (z(Ca2+) = 2 und z(Cl-) = -1): I(CaCl2) = 0,5 * ( z2(Ca2+) * c(Ca2+) + z2(Cl-) * c(Cl-) ) BedeutungDie Ionenstärke wurde bei der Entwicklung der Debye-Hückel-Theorie als praktikable Größe in die Elektrochemie eingeführt. Diese Theorie zeigt, dass die Aktivitätskoeffizienten in verdünnten Lösungen von der Wurzel der Ionenstärke abhängen, und liefert beispielsweise für verdünnte wässrige Lösungen bei 25°C folgende Formel zur Abschätzung von mittleren Aktivitätskoeffizienten f aus der Ionenstärke:
mit A = 0.5091 dm3/2 mol-1/2. |
| Dieser Artikel basiert auf dem Artikel Ionenstärke aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





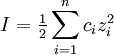 ,
,
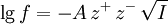 ,
,


