Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Isotherme Zustandsänderung
Weiteres empfehlenswertes FachwissenDie isotherme Zustandsänderung ist eine thermodynamische Zustandsänderung, bei der die Temperatur unverändert bleibt. Bei einer Verdichtung eines Gases muss also die Kompressionswärme abgeführt bzw. bei einer Expansion Wärme zugeführt werden. Dies kann durch ein Wärmebad näherungsweise erreicht werden. Nach dem Gesetz von Boyle-Mariotte und der Zustandsgleichung eines idealen Gases bleibt das Produkt aus Druck p und Volumen V bei konstanter Temperatur T ebenfalls konstant:
Daraus folgt auch, dass sich die Drücke umgekehrt proportional zu den entsprechenden Volumina verhalten: Für die verrichtete Arbeit ΔW gilt bei einer isothermen Kompression oder Expansion von n mol eines idealen Gases:
wobei R die Universelle Gaskonstante bezeichnet. Nach dem ersten Hauptsatz der Thermodynamik (ΔU = ΔQ + ΔW) folgt mit T2 = T1 (und somit ΔT = 0), dass die zugeführte bzw. entzogene Wärme direkt der verrichteten Arbeit entspricht (ΔQ = − ΔW). Daraus folgt ΔU = 0, wobei U die innere Energie darstellt. Alexander von Humboldt zeichnete 1817 die erste Isothermenkarte. Siehe auch |
| Dieser Artikel basiert auf dem Artikel Isotherme_Zustandsänderung aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





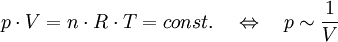 .
.
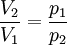
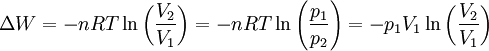 ,
,


