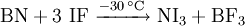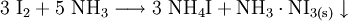Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Iodstickstoff
Iodstickstoff (NI3), oft auch als Stickstofftriiodid bezeichnet (chemisch korrekt wäre Iodnitrid), ist eine äußerst labile chemische Verbindung von Iod und Stickstoff, die bereits bei geringster Energiezufuhr durch Reibung, Schlag oder Erschütterung eine stark exotherme Reaktion (Explosion) zeigt. Stickstofftriiodid gehört zur Stoffgruppe der Stickstoffhalogenide. Aufgrund seiner Instabilität findet Iodstickstoff als Sprengstoff keine praktische Anwendung. Die Synthese von Kleinstmengen ist jedoch zur didaktischen Veranschaulichung im Rahmen des Chemieunterrichts interessant. Getrocknete Reste zerfallen nach kurzer Zeit mit einem spektakulären Knall, der von einer violetten Iod-Wolke begleitet wird. Weiteres empfehlenswertes Fachwissen
SyntheseIn reiner Form wurde Iodstickstoff erstmals 1990 aus Bornitrid und Iodfluorid bei −30 °C in Trichlorfluormethan synthetisiert[2]. Eher gebräuchlich ist die Darstellung durch Einleiten von Iod oder Zugabe von Iodkristallen in eine konzentrierte Ammoniaklösung. Der Stickstoff wird analog zu den Kohlenwasserstoffen halogeniert. Dies führt zur Bildung eines meist als Iodstickstoff bezeichneten polymeren Stickstofftriiodid-Ammoniak-Adduktes, NI3·NH3. Dieses bildet schwarzbraune, rhombische Kristalle, die sich in Wasser zu Iodwasserstoff, Iod und Ammoniak zersetzen. Das Produkt ist hochexplosiv und muss mit der nötigen Vorsicht behandelt werden. EigenschaftenIodstickstoff zersetzt sich unter mechanischer Einwirkung explosionsartig, deshalb ist Vorsicht geboten. Ammoniak-AddukteJe nach Temperatur und Lösungsmittel bildet Iodstickstoff mit Ammoniak den Hydraten entsprechende, verschieden gefärbte, polymere Addukte:[3]
Die beiden letzteren Addukte können ineinander durch Variation der Temperatur umgewandelt werden. Alle Polymere bestehen aus Ketten von NI4-Tetraedern, die zusätzlich von Ammoniakmolekülen umgeben sind. Einzelnachweise
Kategorien: Iodverbindung | Stickstoffverbindung |
||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Iodstickstoff aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||