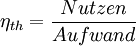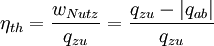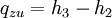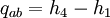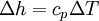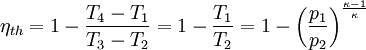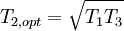Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Joule-KreisprozessDer Joule-Kreisprozess oder Brayton-Kreisprozess ist ein rechtslaufender, thermodynamischer Kreisprozess, der nach dem britischen Physiker James Prescott Joule benannt ist. Er ist ein Vergleichsprozess für den in Gasturbinen und Strahltriebwerken ablaufenden Vorgang und besteht aus zwei isentropen und zwei isobaren Zustandsänderungen. Weiteres empfehlenswertes Fachwissen
Weitere Beschreibung
Die 4 Takte sind im Einzelnen:
Die vom Linienzug (1 - 2 - 3 - 4) umschlossene Fläche entspricht der spezifischen Prozessarbeit w. Im Gegensatz zum geschlossenen Joule-Prozess entfällt im offenen die Kühlung, da kontinuierlich kaltes Gas angesaugt und verdichtet wird. Die Wärmezufuhr, die hier nur schematisch dargestellt ist, wird tatsächlich durch die Verbrennung eines fossilen Energieträgers realisiert. In Strahltriebwerken wird hierzu in der Regel Kerosin verwendet, das bei der Erdöldestillation eine Zwischenfraktion von Benzin und Diesel darstellt.
Die folgenden Bilder zeigen maßstäbliche Diagramme und eine Tabelle mit den Zustandgrößen und Prozessdaten aus einer rechenaktiven Datei.
WirkungsgradAllgemein ist der thermische Wirkungsgrad definiert als das Verhältnis von Nutzen zu Aufwand. Beim Joule-Prozess besteht der Nutzen in der abgegebenen technischen Arbeit wNutz, der Aufwand besteht in der benötigten Wärme qzu, sodass sich formulieren lässt: Die bilanzierten Wärmen ersetzt man durch die Enthalpie-Differenzen. Für ein ideales Gas gilt zudem, dass die spezifische Enthalpie h nur eine Funktion der Temperatur und unabhängig vom Druck ist. deshalb ist Die letzte Beziehung ergibt sich aus der Verwendung der Gleichung für die Temperaturänderung bei isentroper Kompression.
Der reale GasturbinenprozessDer reale Gasturbinenprozess unterscheidet sich durch die Irreversibilität der technischen Zustandsänderungen (1-2, 3-4) vom theoretischen Joule-Prozess. Darüber hinaus treten Druckverluste in der Brennkammer (2-3) (bzw. dem Wärmeübertrager im geschlossenen Gasturbinenprozess) sowie im Abwärmeübertrager (4-1) auf. Die Druckänderung durch die Wärmeverluste in der Brennkammer können heutzutage durch geeignete Maßnahmen (hochtemperaturfeste Keramik) minimiert werden, während der Druckverlust im Wärmeübertrager (4-1) nur bedingt reduzierbar ist. Die genannten Unterschiede sind anschaulich im T-s-Diagramm darstellbar (T-Temperatur, s-spezifische Entropie). Vergleich zwischen realem und idealem Gasturbinen-Prozess im T,s-Diagramm Die technischen Arbeiten für den Verdichter und die Turbine werden im h,s-Diagramm veranschaulicht (h-spezifische Enthalpie, s-spezifische Entropie). Andere Vergleichsprozesse |
||||||
| Dieser Artikel basiert auf dem Artikel Joule-Kreisprozess aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||