Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Joule-VersuchWeiteres empfehlenswertes FachwissenEinführungJames Prescott Joule wollte den Koeffizienten ErklärungDie Änderung der Inneren Energie ist folgendermaßen definiert: dU = dW + dq mit W = Volumenarbeit gegen den Außendruck und q = Wärme. Die Temperatur blieb annähernd gleich, daher gilt hier q = 0. Es wurde auch keine Volumenarbeit verrichtet, da der Druck im Behälter vorher annähernd 0 war. Daraus folgt: dU = dW + dq = 0 + 0 = 0. Hätte er jedoch bessere Messgeräte besessen, so wäre ihm durchaus eine Temperaturänderung aufgefallen. Denn reale Gase besitzen intermolekulare Anziehungskräfte. Um diese zu Überwinden muss Energie aufgewendet werden, die dem System in Form von Wärme entzogen wird. Ideale Gase besitzen keine intermolekularen Anziehungskräfte. Deshalb ist bei diesen die Innere Energie unabhängig vom Volumen. |
| Dieser Artikel basiert auf dem Artikel Joule-Versuch aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





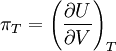 bestimmen. Dazu expandierte er ein Gas in ein evakuiertes Gefäß, das von einem Wasserbad umgeben war und maß die Temperaturänderung des Wasserbads. Leider waren seine Messinstrumente zu ungenau, um die Temperaturänderung die durch den
bestimmen. Dazu expandierte er ein Gas in ein evakuiertes Gefäß, das von einem Wasserbad umgeben war und maß die Temperaturänderung des Wasserbads. Leider waren seine Messinstrumente zu ungenau, um die Temperaturänderung die durch den 

