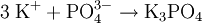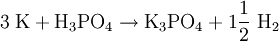Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Kaliumphosphat
Kaliumphosphat ist das Kaliumsalz der Phosphorsäure. Weiteres empfehlenswertes Fachwissen
Gewinnung/DarstellungKaliumphosphat entsteht auch bei dem Erhitzen von Thomasschlacke mit Kohle und Kaliumsulfat. EigenschaftenKaliumphosphat löst sich in Wasser unter alkalischer Reaktion. Herstellung: VerwendungPhosphate werden als Zusatz in Waschmitteln verwendet. Sie sind in der Lage, durch Komplexbildung mit mehrwertigen Metallionen (Mg2+ etc.) die Wasserhärte herabzusetzen. Ihr Einsatz ist heute in einigen Ländern (unter anderem Schweiz) verboten. Phosphate werden auch als Kunstdünger eingesetzt. Biologische BedeutungDie Folge des Einsatzes in Waschmitteln ist eine größeres Nährstoffangebot in Gewässern. Daraus resultiert ein verstärktes Algenwachstum, was zum Umkippen eines Gewässers führen kann. Kaliumphosphat ist in der Homöopathie als Nervenmittel bekannt. Kategorien: Reizender Stoff | Kaliumverbindung | Phosphat |
|||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Kaliumphosphat aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||