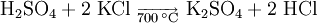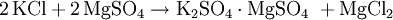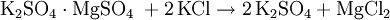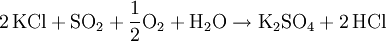Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Kaliumsulfat
Kaliumsulfat, Summenformel K2SO4, ist das Kaliumsalz der Schwefelsäure. Es wird hauptsächlich als Düngemittel verwendet. Weiteres empfehlenswertes Fachwissen
GeschichteAls Erster stellte der Apotheker und Chemiker Johann Rudolph Glauber das bereits seit dem im 14. Jahrhundert bekannte Salz aus Kaliumchlorid und Schwefelsäure her. VorkommenKaliumsulfat findet man in Form von so genannten Doppelsalzen in verschiedenen Mineralien. Beispiele hierfür sind der Schönit, Leonit, Langbeinit, Polyhalit und Glaserit. DarstellungAnfangs wurde Kaliumsulfat aus dem Mineral Kainit (MgSO4 · KCl · 3 H2O) gewonnen. Diese Herstellungsweise wurde jedoch bald zu Gunsten kostengünstigerer Verfahren ausgehend vom Kaliumchlorid aufgegeben. Eine Möglichkeit in der Herstellung von Kaliumsulfat ist die Reaktion von Kaliumchlorid mit Schwefelsäure bei einer Temperatur von 700 °C. Alternativ ist Kaliumsulfat durch die doppelte Umsetzung mit anderen Metallsulfaten wie z. B. Magnesiumsulfat darstellbar: Das so genannte Hargreaves-Verfahren nutzt zur Darstellung von Kaliumsulfat die Umsetzung von Kaliumchlorid mit einem Gemisch aus Schwefeldioxid, Luft und Wasser: Kaliumsulfat fällt zudem als Nebenprodukt bei der Herstellung von Salpetersäure an. Einfacher herzustellen ist Kaliumsulfat über die Reaktion von Kaliumhydroxid und Schwefelsäure. EigenschaftenDie wasserfreien Kristalle sind rhombischer Natur. Sie sind farblos und durchsichtig, sehr hart und äußerst stabil an der Luft. Der Geschmack von Kaliumsulfat ist bitter bis salzig. Während es sich gut in Wasser löst, ist es in Ethanol unlöslich. VerwendungKaliumsulfat verwendet man zur Herstellung von Kalialaun, Kaliwasserglas, Kaliumpersulfat, Pottasche, Phlegmatoren, Mineralwässern, synthetischem Gummi sowie Mischdüngern. Des Weiteren findet es Anwendung bei der Weinstein- und Weinsäure-Reinigung und vielfältige Verwendung in der Farbstoff-, Sprengstoff- und pharmazeutischen Industrie. In diätischen Lebensmitteln dient Kaliumsulfat als Kochsalz-Ersatz. Ferner ist es Bestandteil von Kalidüngern, die zur Düngung Chlorid-empfindlicher Pflanzenkulturen z. B. im Weinbau zum Einsatz kommen. Es ist in der EU als Lebensmittelzusatzstoff der Nummer E 515 zugelassen. Kaliumsulfat wird auch als Wirkstoff in Löschpulvern der Brandklassen B und C eingesetzt. QuellenHolleman, Wiberg, Lehrbuch der Anorganischen Chemie, deGruyter Verlag, 101. Auflage, S. 1179 Kategorien: Kaliumverbindung | Sulfat |
|||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Kaliumsulfat aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||