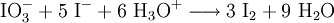Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
KomproportionierungEine Komproportionierung - auch Synproportionierung genannt - ist das Gegenteil der Disproportionierung. Beides sind Spezialfälle einer Redoxreaktion. Bei der Komproportionierung wird durch gleichzeitige Reduktion und Oxidation aus einer höheren und einer niedrigeren Oxidationsstufe zweier Atome des gleichen Elementes eine mittlere Oxidationsstufe gebildet. Weiteres empfehlenswertes FachwissenBeispielEin Beispiel ist die Reaktion von Iodat mit Iodid in saurer Lösung unter Bildung von elementarem Iod (chem. Zeichen: "I"). Das I(+V) im Iodat wird in dieser Reaktion reduziert, das I(-I) im Iodid oxidiert. Im Produkt liegt das Iod in der Oxidationsstufe 0 vor.
Siehe auch |
| Dieser Artikel basiert auf dem Artikel Komproportionierung aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |