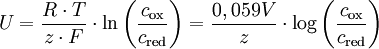Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
KonzentrationselementEin Konzentrationselement ist eine galvanische Zelle, in der auf Grund chemischer Reaktionen ähnlich einer Batterie eine nutzbare elektrische Spannung entsteht. Weiteres empfehlenswertes FachwissenDas Besondere an einer solchen Konzentrationskette ist, dass sie aus zwei Halbzellen besteht, die gleichartig aufgebaut sind und sich nur in der Elektrolytkonzentration unterscheiden. Die beiden Elektroden bestehen also aus dem gleichen Material und die Elektrolyte enthalten die gleichen Ionensorten. Die chemische Reaktion in der einen Halbzelle ist daher bei Stromfluss die Umkehrung der Reaktion in der anderen. Da die beiden Halbzellen jedoch die Tendenz haben, die Konzentrationen anzugleichen, entsteht dennoch eine messbare Spannung. Die Konzentrationskette dient heute vor allem zu Demonstrationszwecken, da man mit ihr die Konzentrationsabhängigkeit des Elektrodenpotentials bzw. des chemischen Potentials qualitativ zeigen und quantitativ überprüfen kann. Dadurch kann man sie nutzen, um die Nernst-Gleichung herzuleiten. Beispiel: Metall-Auflösung und -AbscheidungHäufig werden Konzentrationszellen benutzt, bei denen Metallelektroden in Lösungen eines Salzes desselben Metalls tauchen, z. B. Zinkelektroden in Zinksalzlösungen oder Kupferelektroden in Kupfersulfatlösung. Dann wird in der einen Zelle das Metall in Lösung gehen, in der anderen wird es wieder abgeschieden. Da sich beim Stromfluss die Konzentrationen angleichen, wird das Metall in der Halbzelle mit dem verdünnten Elektrolyten lösen und in derjenigen mit der konzentrierteren abscheiden. Schließt man die Zelle kurz, so dass Strom fließen kann und die Reaktionen stattfinden können, wird folgendes ablaufen: Auf der Seite mit der verdünnteren Lösung wird das Metall der Elektrode unter Abgabe von Elektronen zu Metallionen oxidiert; es geht als Ionen in die verdünnte Lösung über und erhöht die Konzentration in der Halbzelle. Auf Grund der Elektronenabgabe ist dies die negative Elektrode, der Minuspol. Da hier eine Oxidation erfolgt, ist es definitonsgemäß die Anode. Wie bei den Batterien ist also hier der Minuspol die Anode. Die freiwerdenden Elektronen wandern zur anderen Elektrode. Dort reduzieren sie die in der konzentrierten Lösung vorhandenen Metallionen zu elementarem Metall, das sich an der Elektrode anlagert. Auf Grund der Reduktion ist dies die Kathode, da die Metallionen eine positive Ladung mitbringen, wenn sie sich anlagern, ist dies der Pluspol. Die Konzentration dieser Halbzelle sinkt. Die Konzentrationen beider Halbzellen nähern sich somit aneinander an, bis kein Konzentrationsunterschied mehr besteht. Berechnung der SpannungZur Berechnung der Potentialdifferenz der galvanischen Zelle kann man die Nernst-Gleichung benutzen. Da das Standardpotential (siehe Elektrochemische Spannungsreihe) der beiden Halbzellen gleich ist lässt sich die Nernst-Gleichung zum folgenden Term vereinfachen:
Bezeichnungen:
|
| Dieser Artikel basiert auf dem Artikel Konzentrationselement aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |