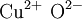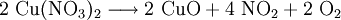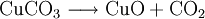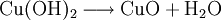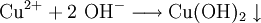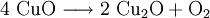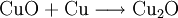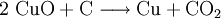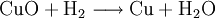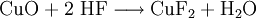Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Kupfer(II)-oxid
Kupfer(II)-oxid ist eine chemische Verbindung, die Kupfer und Sauerstoff enthält. In diesem Oxid mit der Summenformel CuO ist Kupfer zweiwertig. Kupfer(II)-oxid ist ein schwarzer, amorpher oder kristalliner Feststoff. Weiteres empfehlenswertes Fachwissen
VorkommenIn der Natur kommt Kupfer(II)-oxid als das Mineral Tenorit vor. Tenorit entsteht bei der Verwitterung von Kupfersulfiden und findet sich daher üblicherweise in oxidierten Teilen von Kupfervorkommen. Das Mineral ist nach dem italienischen Botaniker Michele Tenore (*1780; †1861) benannt. Gewinnung und DarstellungKupfer(II)-oxid kann durch thermische Zersetzung (Pyrolyse) von Kupfer(II)-nitrat oder Kupfer(II)-carbonat dargestellt werden. Kupfer(II)-oxid kann auch durch Erwärmen von (frisch gefälltem) Kupfer(II)-hydroxid hergestellt werden. Das Kupfer(II)-hydroxid wird durch Zugabe von Alkalihydroxiden zu einer Cu(II)-Salzlösung ausgefällt. Kupfer(II)-oxid bildet sich zusammen mit Kupfer(I)-oxid beim Erhitzen von metallischem Kupfer auf Rotglut an Luft. EigenschaftenKupfer(II)-oxid ist unlöslich in Wasser und Alkoholen. Dagegen ist es in verdünnten Säuren löslich. Durch Eindampfen können die entsprechenden Kupfer(II)-salze erhalten werden. Kupfer(II)-oxid ist unter Komplexbildung in Ammoniumhydroxid löslich. Kupfer(II)-oxid adsorbiert leicht Sauerstoff, Stickstoff, Kohlendioxid und andere Gase. Beim Erhitzen über etwa 800 °C wird Kupfer(II)-oxid unter Sauerstoffabgabe zu Kupfer(I)-oxid umgewandelt. Werden metallisches Kupfer und Kupfer(II)-oxid zusammen erhitzt entsteht ebenfalls Kupfer(I)-oxid. Kupfer(II)-oxid wird bei erhöhter Temperatur durch verschiedene Reduktionsmittel (beispielsweise Kohlenstoff, Kohlenmonoxid,Wasserstoff) zu metallischem Kupfer reduziert. Beim Erhitzen von Kupfer(II)-oxid mit Fluorwasserstoff auf 400 °C wird Kupfer(II)-fluorid gebildet. VerwendungKupfer(II)-oxid wird als Pigment zum Färben von Glas, Keramik, Porzellan und künstlichen Edelsteinen verwendet. Daneben findet es Anwendung als Kathodenmaterial in Batterien, als Katalysator, zur Entschwefelung von Erdöl und für fäulnishemmende Anstriche. Kupfer(II)-oxid wird auch als Ausgangstoff für die Herstellung von verschiedenen Kupferverbindungen genutzt. Quellen
Kategorien: Gesundheitsschädlicher Stoff | Kupferverbindung | Oxid |
|||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Kupfer(II)-oxid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||