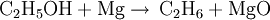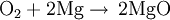Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Magnesiumoxid
Magnesiumoxid (MgO) oder Magnesia ist ein Salz, bestehend aus Mg2+ und O2−-Ionen. Es kristallisiert im Natriumchlorid-Gitter. Magnesiumoxid entsteht durch das Verbrennen von Magnesium, es kann durch Fällung aus Meerwasser gewonnen werden oder die Herstellung erfolgt über das Erhitzen einer Magnesiumverbindung (zum Beispiel Magnesiumhydroxid Mg(OH)2 oder Magnesiumcarbonat MgCO3). Weiteres empfehlenswertes FachwissenIm letzten Fall hängt das chemische Verhalten des Magnesiumoxids sehr stark von der Herstellungstemperatur und dem Herstellungsverfahren ab. Beim „Brennen“ von natürlich vorkommendem Magnesiumcarbonat (Magnesit) bei etwa 800 °C entsteht sogenannter „kaustisch gebrannter Magnesit“. Während des Brennvorgangs entweicht das Kohlendioxid, jedoch ist die Temperatur zu niedrig, um ein Sintern zuzulassen. Die entstehenden Magnesiumoxidkörner haben daher noch die äußere Form des Magnesiumcarbonats, sind porös und durch die große innere Oberfläche sehr reaktionsfähig. Mit Wasser entsteht in kurzer Zeit Magnesiumhydroxid. Die Reaktion einiger in Wasser gelöster Magnesiumsalze mit kaustisch gebranntem Magnesit führt zur Auskristallisation einer steinharten Masse. Ist das Magnesiumsalz Magnesiumchlorid MgCl2, so spricht man von Sorelzement. Dieser wird für die Herstellung von Industriefußböden verwendet. Weiterhin wird kaustisch gebrannter Magnesit in der Dünge- und Futtermittelindustrie als Magnesiumträger verwendet. Auch wird Magnesiumoxid zur Substitutionstherapie verwendet. Bei 1700 °C bis 2000 °C bildet sich Sintermagnesia, oberhalb von 2800 °C Schmelzmagnesia. Beide Sorten reagieren kaum noch mit Wasser. Sintermagnesia wird wegen seiner Feuerfestigkeit (Schmelzpunkt 2800 °C) für Ofenauskleidungen und Laborgeräte verwendet. Magnesia wird zur Erzeugung basischer Feuerfestmaterialien für die Zementherstellung, zur Gewinnung von Buntmetallen, Stahlveredlern und Glas sowie zur Herstellung von Magnesia-Kohlenstoff-Steinen verwendet, dem wichtigsten Material zur Herstellung feuerfester Auskleidungen von Gefäßen zur Stahlherstellung (Konverter, Elektrolichtbogenofen und Gießpfanne). Ohne Magnesia sind diese Materialien mit modernen Methoden nicht herstellbar. Ebenso wurde dieser Stoff wegen seiner Hitzefestigkeit in der Vergangenheit für Isolierröhrchen zwischen Heizfaden und Kathode von Elektronenröhren verwendet. In der Natur kommt Magnesiumoxid als vulkanisches Mineral Periklas vor. Es sind graue bis dunkelgrüne, glasglänzende reguläre Kristalle der Härte 5,5 bis 6. Es wird Lebensmitteln als Säureregulator oder Trennmittel zugesetzt. Es ist in der EU als Lebensmittelzusatzstoff der Bezeichnung E 530 ohne Höchstmengenbeschränkung (quantum satis) für Lebensmittel allgemein zugelassen. HerstellungZur Herstellung von Magnesiumoxid gibt es mehrere Möglichkeiten: Ethanoldampf (durch Erhitzung) reagiert mit Magnesium zu Magnesiumoxid und Ethan:
Durch Verbrennen von Magnesium an der Luft reagiert es mit Sauerstoff zu Magnesiumoxid:
EinzelnachweiseKategorien: Oxid | Oxidkeramik | Magnesiumverbindung | Arzneistoff |
||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Magnesiumoxid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||