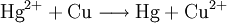Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Amalgam
Da viele Metalle in Quecksilber löslich sind (eine Ausnahme ist zum Beispiel Eisen), gibt es sehr viele Amalgame. Amalgame mit sehr großem Quecksilberanteil sind oft bei Raumtemperatur – wie das Quecksilber selbst – flüssig, bei kleineren Quecksilbergehalten sind sie fest. In der klassischen Alchemie wird die Amalgamierung des Quecksilbers mit anderen Metallen oft mit der körperlichen Vereinigung verglichen. Als alchemistisches Lexem ist mlat. amalgama seit dem 13. Jahrhundert belegt. Weiteres empfehlenswertes Fachwissen
EinsatzgebieteFüllungstherapiesiehe Hauptartikel Amalgamfüllung In der Zahnmedizin wird Quecksilberamalgam in großem Umfang als Zahnfüllungsmaterial eingesetzt und ist seit seiner Einführung stark umstritten. Die Europäische Union stellt in ihrer Gemeinschaftsstrategie für Quecksilber fest, dass das Einatmen von Quecksilberdampf aus zahnmedizinischem Amalgam die Hauptquelle der Quecksilberexposition der Bevölkerung in den Industrieländern ist. [1] Eine Gesundheitsgefährdung durch die aus Quecksilberamalgam aufgenommene Quecksilbermenge ist wissenschaftlich umstritten. So findet zum Beispiel eine Übersichtsstudie im Auftrag der US-Zahnärzteorganisation ADA nur wenige Hinweise einer Gefährdung und befürwortet die Weiterverwendung von Amalgam. [2] Andererseits warnt die schwedische Regierungskommission für Zahnmaterial, dass durch den Quecksilberdampf aus Amalgamfüllungen aktuelle Grenzwerte überschritten werden, und „Amalgam ein unpassendes Material zur Füllungstherapie bei Karies“ ist. [3] Andere EinsatzgebieteEin technisch wichtiges und in großem Maßstab hergestelltes Amalgam ist das Natriumamalgam, das bei der Chlor-Alkali-Elektrolyse als Zwischenprodukt entsteht. Es wird mit Wasser zu Natronlauge, Wasserstoff und Quecksilber zersetzt, das im Kreislauf wieder zur Elektrolyse verwendet wird. Da die Alkalimetalle Amalgame bilden, zum Beispiel bei der Elektrolyse von Lösungen der Alkalimetallionen mit Quecksilberelektroden, hat man auch versucht, ein Ammonium- beziehungsweise Ammoniakamalgam herzustellen (das Ammoniumion verhält sich oft den Alkalimetallionen ähnlich); Ammoniumamalgam zersetzt sich aber zu Quecksilber, Ammoniak und Wasserstoff. Bei der Goldgewinnung wird teilweise noch Quecksilber eingesetzt. Dieses bildet mit dem Gold, das in kleinen Flittern mit Gestein vermengt vorliegt, ein zunächst flüssiges Amalgam. Um reines Gold zu erhalten, wird das Amalgam erhitzt. Dabei entstehen sehr giftige Quecksilberdämpfe. Aluminiumamalgam wird als Reduktionsmittel verwendet. Thalliumamalgam wird wegen seines niedrigen Gefrierpunkts von -58 Grad Celsius als Thermometerflüssigkeit für Tieftemperaturthermometer verwendet. Zinnamalgam bildete bis in die Mitte des 19. Jahrhunderts die reflektierende Beschichtung von Spiegeln.[4] Die AmalgamprobeQuecksilbersalze sind im Unterschied zu Quecksilbermetall und Amalgam auf Grund ihrer Wasserlöslichkeit hochgiftig. Man weist sie durch die so genannte Amalgamprobe nach: Die salpetersaure Lösung wird auf ein Kupferblech gegeben – zurück bleibt ein nicht abwischbarer, silbriger Amalgamfleck:
Das Quecksilber bildet dabei mit dem Kupferblech eine Legierung, das Kupfer-Amalgam. Silbersalze würden ebenfalls diese Flecke bilden, jedoch ist das dabei entstehende Silber fest und somit abwischbar. Somit sind letztendlich Silbersalze von Quecksilbersalzen unterscheidbar. Das AmalgamverfahrenBei der Chloralkalielektrolyse zur großtechnischen Gewinnung von Chlor, Natronlauge und Wasserstoffgas wird bei dem Amalgamverfahren Quecksilber als Kathode eingesetzt, so dass sich das aus Salzwasser durch Reduktion bildende Natrium als Amalgam abscheidet. Anschließend wandert das Natriumamalgam zum Amalgamzersetzer, wo es mit Wasser zu salzfreier Natronlauge, Wasserstoffgas und Quecksilber reagiert. Dieses Elektrolyseverfahren hat den Vorteil, dass es kochsalzfreies Natriumhydroxid liefert (Natronlauge), ist jedoch ökologisch bedenklich, da den Produkten Quecksilberreste entzogen werden müssen (Nachreinigung, Entgiftung z. B. mit Aktivkohlefiltern). Siehe auch
Einzelnachweise
|
|
| Dieser Artikel basiert auf dem Artikel Amalgam aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |