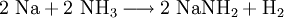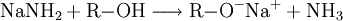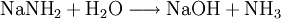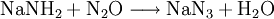Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Natriumamid
Natriumamid ist eine farblose, grobkristalline oder pulverige Verbindung der Zusammensetzung (NaNH2). Sie ist im Labormaßstab aus Natrium-Metall und flüssigem Ammoniak in Gegenwart von Fe3+ unter Wasserstoff-Freisetzung darstellbar. Weiteres empfehlenswertes FachwissenOhne Eisen-Katalysator wird nicht das Amid gebildet (anders als bei der analogen Synthese von NaOH aus Na und Wasser), stattdessen kommt es zur Solvatisierung des 3s-Valenzelektrons des Natrium im Ammoniak. Die freien Elektronen führen zu einer tiefen Blaufärbung der Lösung, die gewissermaßen als ammoniakalische Lösung des hypothetischen „Salzes“ Na+e− aufgefasst werden. Dampft man die Lösung ein, wird Na+ wieder zum Element reduziert, die Ausbeute an NaNH2 beläuft sich so nur auf weniger als 0,5 %. Natriumamid wird als sehr starke Base in der Organischen Chemie zur Deprotonierung wenig acider Substanzen eingesetzt, so z. B. zur Erzeugung stark gespannter Arine (Dehydrobenzole) mit formeller Dreifachbindung im Sechsring, welche gewissermaßen durch eine E1CB-Reaktion oft unter formeller HX-Eliminierung (X = F, Cl, Br, I) entstehen. Ein weiteres Beispiel ist die Ethylierung, bei der im ersten Schritt Acetylen durch Natriumamid deprotoniert wird. Natriumamid ist ebenfalls in der Lage, Alkohole zu Alkoholaten zu deprotonieren. Mit Wasser reagiert Natriumamid heftig zu Natriumhydroxid und Ammoniak, was aufgrund der Basennivellierung zu einem Verlust der starken Basizität führt; da ja im wässrigen System die stärkste existente Base das OH−-Ion ist. Die volle Basenstärke kann somit nur im NH3-System oder organischen Lösungen genutzt werden. Natriumamid wird durch Luftsauerstoff langsam oxidiert, dabei bilden sich z. T. explosive Reaktionsprodukte. Es empfiehlt sich daher die Verbindung in einer Schutzflüssigkeit (Petroleum) aufzubewahren oder besser sofort zu verbrauchen. Alte, oxidierte Präparate sind nicht mehr brauchbar und müssen unter angemessenen Vorsichtsmaßnahmen entsorgt werden. VerwendungNatriumamid wird für organisch-chemische Synthesen (Farbstoffe z. B. Indigo) sowie zur Herstellung von Natriumazid verwendet. Einzelnachweise
Kategorien: Feuergefährlicher Stoff | Ätzender Stoff | Umweltgefährlicher Stoff | Amid | Natriumverbindung |
||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Natriumamid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||