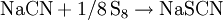Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Natriumthiocyanat
Natriumthiocyanat ist eine gesundheitsschädliche chemische Verbindung mit der Formel NaSCN, die bei Raumtemperatur als weißer, hygroskopischer Feststoff vorliegt.[2] Es wird in vielen Synthesen verwendet, die das Thiocyanation (Rhodanid) SCN− benötigen. Weiteres empfehlenswertes Fachwissen
Darstellung, Eigenschaften und VerwendungDie Darstellung von Natriumthiocyanat wird mit Natriumcyanid und elementarem Schwefel durchgeführt: Kristalle von NaSCN sind orthorhombisch, wobei jedes Na+ von drei Schwefel- und drei Stickstoffliganden umgeben ist.[3] Verwendung findet NaSCN bei der Umwandlung von Halogenalkanen in entsprechende Alkylthiocyanate, wobei auch Kaliumthiocyanat und seltener Ammoniumthiocyanat eingesetzt werden können. Diese Verbindungen werden auch als Pseudohalogenide bezeichnet, da sie viele Analogien zu den echten Halogeniden aufweisen. Beispiele für derartige Synthesen sind die Herstellung von Isopropylthiocyanat (Siedepunkt 146–151 °C) aus Isopropylbromid mit NaSCN in heißem Ethanol.[4] Durch starke Säuren wird aus NaSCN Isothiocyansäure (S=C=NH, pKa = −1,28) freigesetzt.[5] Zur Herstellung von Thioharnstoff wird aus NaSCN das instabile HSCN in situ erzeugt, welches dann mit organischen Aminen Thioharnstoffverbindungen bildet.[6] Wie die beiden anderen erwähnten Thiocyanate (von K+ und NH4+) wird NaSCN in der Phototechnik (Sensibilisierung), Galvanotechnik (Glanzbildner für Kupferbäder), Metallurgie (Extraktion von Zirconium, Hafnium und Lanthanoiden), Textilindustrie (Färbehilfsmittel, Bedrucken), chemischen Industrie und Analytik (Produktion von Herbiziden und Fungiziden, Fe3+-Nachweis) verwendet. Natriumthiocyanat ist als mindergiftig eingestuft, d. h. gesundheitsschädlich beim Verschlucken und bei Berührung mit der Haut, allerdings entwickelt es bei Kontakt mit Säure sehr giftige Gase. Das krebserzeugende und wassergefährdende Potential von NaSCN ist als relativ gering zu bewerten. Siehe auchQuellen
Literatur
Kategorien: Gesundheitsschädlicher Stoff | Natriumverbindung | Thiocyanat | Pseudohalogen |
|||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Natriumthiocyanat aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||