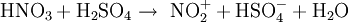Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
NitrierungDie Nitrierung ist in der Chemie das Einführen einer Nitrogruppe (NO2) in ein organisches Molekül. Synonym steht dieser Begriff meist für die Nitrierung aromatischer Verbindungen, welche als elektrophile aromatische Substitution charakterisiert werden kann. Da in den nitrierten organischen Verbindungen Kohlenstoffatome durch Stickstoffatome von Sauerstoffatomen getrennt sind, kann es passieren, dass das Stickstoffatom die Bindung verlässt und das Kohlenstoffatom mit dem Sauerstoffatom heftig reagiert. Daher sind die meisten nitrierten organischen Verbindungen als Sprengstoffe zu gebrauchen. Ein bekanntes Beispiel ist Trinitrotoluol (TNT). Weiteres empfehlenswertes FachwissenReaktionsmechanismusDie Nitrierung eines Aromaten ist das klassische Beispiel für die elektrophile aromatische Substitution. Als elektrophiles Teilchen fungiert das Nitryl-Kation NO2+. Dieses Nitryl-Kation entsteht durch Dehydratisierung (Wasserabspaltung) aus der protonierten Salpetersäure und ist in stark saurem Medium recht stabil. Es ist in zahlreichen Verbindungen isolierbar (z. B. (NO2)(BF4) oder (NO2)(S2O7H)). Der Aromat (1) wechselwirkt mit Nitryl-Kation, was auch als π-Komplex bezeichnet wird. Daraus bildet sich der sogenannte Sigma-Komplex, dessen positive Ladung über den Ring delokalisiert ist (2b). Bei diesem Vorgang wird die Aromoatizität aufgehoben. Schließlich erfolgt eine Deprotonierung des Sigma-Komplexes, so dass der nitrierte Aromat freigesetzt wird (3).
|
| Dieser Artikel basiert auf dem Artikel Nitrierung aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |