Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Normalität
Unter Normalität versteht man die Anzahl der in einem Liter einer Lösung gelöster Grammäquivalente oder Val. Ein Grammäquivalent ist diejenige Masse an Stoff, die ein Mol z.B. Protonen (H+-Ionen) oder Elektronen abgeben oder aufnehmen kann. Im Gegensatz zu Molarität spielt bei der Normalität einer Säure oder Base auch der Dissoziationsgrad und die Wertigkeit, also wie viele Protonen pro Molekül aufgenommen bzw. abgegeben werden können, eine Rolle. Wie alle volumenbezogenen Gehaltsangaben ist auch die Normalität temperaturabhängig. Weiteres empfehlenswertes Fachwissen
DefinitionDie Normalität ist definiert durch die Gleichung:
Hierbei ist N die Normalität, c die Stoffmengenkonzentration und z die Wertigkeit. BeispieleUm eine 1 N Lösung herzustellen, muss beispielsweise zu 36,5 g HCl, 49 g H2SO4, 40 g NaOH oder 85,5 g Ba(OH)2 so viel Lösemittel - meist Wasser oder Alkohol - gegeben werden, dass genau ein Liter Lösung entsteht. Natriumcarbonat (Na2CO3) besteht aus zwei Natrium-Ionen (Na+) und einem Carbonat-Ion. Somit entspricht eine 1 molare (M) Natriumcarbonat-Lösung einer 2 normalen (N) Natriumcarbonat-Lösung bezogen auf die Natrium-Ionen (z = 2). Siehe auchQuellen
|
|
| Dieser Artikel basiert auf dem Artikel Normalität aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





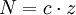 .
.


