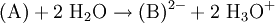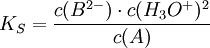Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Phenolphthalein
Phenolphthalein ist ein Triphenylmethan-Farbstoff und einer der bekanntesten pH-Indikatoren. Weiteres empfehlenswertes Fachwissen
EigenschaftenPhenolphthalein hat einen pKs-Wert von 9,2. Wenn man den Umschlagsbereich festlegt bei einem Indikatorsäure/-base-Verhältnis von 10:1 bis 1:10, erhält man nach der Henderson-Hasselbalch-Gleichung einen Umschlagbereich von pH = pKs ± 1 (8,2 bis 10,2). Bei einem pH-Wert von 0 bis etwa 8,2 ist gelöstes Phenolphthalein farblos, bei höherem pH-Wert färbt die Lösung sich rötlich-lila, im stark alkalischen Bereich, bei einem pH-Wert nahe 14, wird sie wieder farblos. Es ist daher beispielsweise bei der Titration basischer Lösungen gut als Indikator geeignet. Phenolphthalein ist in Wasser nicht löslich und findet meist in 0,1 %iger alkoholischer Lösung Verwendung. Es ist selbst eine schwache Säure. VerwendungBis zur Entdeckung einer möglicherweise karzinogenen Wirkung wurde Phenolphthalein für mehr als hundert Jahre als Abführmittel verwendet. Die kleinen Mengen, die beim Einsatz als Indikator verwendet werden, sind jedoch nicht gefährlich. Im Bauwesen wird Phenolphthalein-Lösung zur Visualisierung der Carbonatisierungstiefe an Beton und zur Feststellung der Überarbeitbarkeit von neu verputzten Flächen (Fläche mit einem pH-Wert von kleiner 8,5) verwendet. Reduziertes Phenolphthalein wird im Kastle-Meyer-Test zum Nachweis von Blutspuren in der Forensik verwendet. SyntheseZur Synthese benötigt man Phenol, Phthalsäureanhydrid, konzentrierte Schwefelsäure, Natronlauge, Salzsäure, Methanol. Es findet eine Friedel-Crafts-Reaktion statt. Man gibt etwa 1 cm hoch Phenol (2 Äquivalente) in ein Reagenzglas, das man vorsichtig erwärmt (beispielsweise mit einem Bunsenbrenner), bis es flüssig wird. Man gibt eine Spatelspitze Phthalsäureanhydrid (1 Äquivalent) und ein paar Tropfen konzentrierte Schwefelsäure hinzu. Man erhitzt wiederum, bis eine Rotfärbung auftritt. Man lässt die Schmelze kühlen (Zimmertemperatur), gibt 5 ml Methanol dazu und schüttelt. Danach filtriert man die farblose Lösung ab. FarbumschlagIn Abhängigkeit vom pH-Wert der Lösung ändert das Phenolphthalein seine Struktur und damit seine Farbe.
Im pH-Bereich bis etwa 7,5 liegt es in seiner farblosen, ungeladenen Grundform vor (H2In, A in der Zeichnung) vor. In stärker basischer Lösung werden die Protonen an den beiden Hydroxylgruppen abgespalten (B1). In einer resultierenden mesomeren Grenzstruktur ist ein chinoides System als Chromophor vorhanden (In2−, B2). Das ist die farbige Struktur des Indikators. In sehr stark basischer Umgebung lagert sich am zentralen Kohlenstoffatom eine OH-Gruppe an, wodurch das Erreichen der Chromophorstruktur unmöglich wird (In(OH)3−, C).
Betrachtet man die Reaktionsgleichung der Reaktion (A) nach (B), so wird anhand des Massenwirkungsgesetzes deutlich, warum der Farbumschlag so schnell erfolgt: Es gilt (Ks konstant, wobei die quasi konstante Konzentration des Wassers in Ks einbezogen ist) Die Konzentration der H3O+-Ionen liegt in einer anderen Größenordnung. Für saure Lösungen ist sie hoch, das Gleichgewicht liegt auf der Seite von (A). Sobald aber die Konzentration von H3O+ sehr klein wird beziehungsweise die Konzentration von OH− groß wird, muss sich wegen der Konstanz des Terms die Konzentration von (B) massiv erhöhen. Weil (B) aus (A) entsteht, wird die Konzentration von (A) extrem viel kleiner – der Farbumschlag erfolgt sehr schnell. In stark saurer Lösung wird Phenolphthalein wieder farbig. Ein Proton lagert sich dabei an der chinoiden Struktur an, ohne sie zu zerstören. Dabei wird das Sauerstoffatom positiv geladen; das Chromophor wird dabei nicht aufgelöst. Quellen |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Phenolphthalein aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||