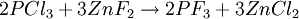Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Phosphor(III)-fluorid
Phosphor(III)-fluorid ist ein giftiges, in geringen Konzentrationen geruchloses, farbloses Gas. In Wasser hydrolisiert es langsam, in Alkalien schnell zu Phosphonsäure bzw. Phosphonaten. Mit vielen Lewis-Säuren bildet es stabile Komplexe. Weiteres empfehlenswertes Fachwissen
Gewinnung und DarstellungPhosphortrifluorid wird üblicherweise durch Halogenaustausch aus Phosphortrichlorid mittels Fluorwasserstoff, Arsenfluorid, Calciumfluorid oder Zinkfluorid hergestellt. EigenschaftenPhysikalische EigenschaftenDas Molekül ist trigonal-pyramidal gebaut und verfügt über einen Bindungswinkel von 98°. Die Phosphor-Fluor Bindung ist 156 pm lang, die Bindungsenthalpie beträgt bei Standardbedingungen 499 kJ/mol. Das Phosphoratom gibt bei der Kernresonanzspektroskopie bei einer chemischen Verschiebung von 97 ppm ein Signal.
Chemische EigenschaftenPhosphor(III)-fluorid hydrolisiert in Wasser langsam, in Alkalien schnell zu Phosphonsäure und Fluorwasserstoffsäure bzw. Phosphonaten und Fluoriden. Im Vergleich zu Phosphortrichlorid hydrolisiert Phosphortrifluorid aber langsamer. Phosphortrifluorid ist eine sehr schwache Lewis-Säure aber eine sehr starke Lewis-Base. Also solche bildet es mit vielen Lewis-Säuren stabile Komplexe. Bei vielen Metallcarbonylen ist es außerdem in der Lage, das Kohlenmonoxid zu verdrängen und zu ersetzen. VerwendungGroßtechnisch findet Phosphortrifluorid keine Verwendung, in der Forschung wird es aber in der organischen Synthese und zur Herstellung von Komplexen Verwendung. Biologische BedeutungPhosphor(III)-fluorid ist für den Menschen stark giftig, da es wie Kohlenmonoxid irreversibel an Hämoglobin bindet und somit die Sauerstoffatmung verhindert. Quellen
Kategorien: Giftiger Stoff | Ätzender Stoff | Phosphorverbindung | Fluorverbindung |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Phosphor(III)-fluorid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||