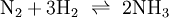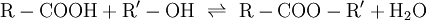Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Prinzip vom kleinsten ZwangDas Prinzip von Le Chatelier, auch das Prinzip vom kleinsten Zwang genannt, wurde von Henry Le Chatelier und Ferdinand Braun zwischen 1884 und 1888 formuliert: Weiteres empfehlenswertes FachwissenÜbt man auf ein chemisches System im Gleichgewicht einen Zwang aus, so reagiert es so, dass die Wirkung des Zwanges minimal wird. „Zwänge“ sind in diesem Sinne Änderungen von Temperatur, Druck oder Stoffkonzentration:
TemperaturänderungWärmeentzug begünstigt die exotherme Reaktion, Wärmezufuhr begünstigt die endotherme Reaktion. Als Beispiel kann das Gasgemisch aus dem Gleichgewicht zwischen dem braunen Stickstoffdioxid und dem farblosen Distickstofftetroxid dienen: Die Enthalpie der Hinreaktion beträgt Erhöht man nun die Temperatur bei konstantem Volumen, so wird die Reaktion in die entgegengesetzte, also in die endotherme Richtung ablaufen, womit sich das Gleichgewicht nach links verschiebt, das Gasgemisch wird dunkler. Temperatursenkung bewirkt die exotherme Reaktion, wodurch sich das Gleichgewicht nach rechts verschiebt und das Gasgemisch sich aufhellt. DruckänderungEin Gleichgewichtssystem reagiert unter Druck so, dass die Teilchenanzahl der Druckänderung entgegenwirkt. Eine bekannte Reaktion ist die Herstellung von Ammoniak im Haber-Bosch-Verfahren aus Stickstoff und Wasserstoff: Es entstehen also aus 4 Gasmolekülen auf der Eduktseite links 2 Gasmoleküle auf der Produktseite rechts. Wird nun der Druck erhöht, so weicht das System auf die volumenverkleinernde Seite - also diejenige mit weniger Molekülen - aus. Somit lässt sich durch Druckerhöhung die Bildung von Ammoniak begünstigen. Beim Haber-Bosch-Verfahren wird diese Reaktion daher bei ca. 450 MPa Druck durchgeführt. Das gleiche Prinzip lässt sich auch auf das Stickstoffdioxid-Distickstofftetroxid-Gleichgewicht übertragen. StoffmengenänderungDer Einfluss von Änderungen der Stoffmenge auf die Lage eines Gleichgewichts lässt sich an der Veresterung von Carbonsäuren bzw. der Hydrolyse von Carbonsäureestern verdeutlichen. Wenn eine Carbonsäure in einem Alkohol gelöst wird, befindet sich das System zunächst nicht im Gleichgewicht. Wenn sich das Gleichgewicht eingestellt hat (z. B. nach Zugabe eines Katalysators oder nach –sehr langem– Warten) und die erste Reaktion abgelaufen ist, hat sich die Menge des Alkohols kaum verändert, es hat sich der Ester und eine entsprechende Menge Wasser gebildet und es ist eine sehr kleine Menge Carbonsäure übrig. Wenn jetzt die Mengen von Wasser und Alkohol verändert werden, z.B. durch Abdestillieren des Alkohols und Zugabe von Wasser, und anschließend wieder das Gleichgewicht eingestellt wird, so läuft eine umgekehrte Reaktion ab. Die Menge des Wassers, da im großen Überschuss vorhanden, verändert sich fast nicht, der Ester wird nahezu vollständig verbraucht, die Carbonsäure und der Alkohol werden zurückgebildet. Das bedeutet, dass man durch Zugabe einer Reaktionskomponente im Überschuss (Alkohol bzw. Wasser) steuern kann, welches Reaktionsprodukt (Ester oder Säure) im Gleichgewicht überwiegt. |
| Dieser Artikel basiert auf dem Artikel Prinzip_vom_kleinsten_Zwang aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





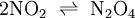
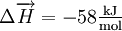 , d. h. es handelt sich um eine
, d. h. es handelt sich um eine 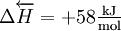 .
.