Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
ReaktionsgleichungIn der Chemie ist eine Reaktionsgleichung – auch Reaktionsschema genannt – die Kurzschreibweise für eine chemische Reaktion. Sie gibt die Ausgangs- und Endstoffe einer Stoffumwandlung in Formelschreibweise wieder, ist international einheitlich und wird von allen Chemikern verstanden. Da Ausgangs- und Endstoffe jedoch bei einer Stoffumwandlung eben NICHT gleich sind, sollte der Ausdruck "Gleichung" in der Mathematik belassen werden, während in der Chemie fachlich korekter eher von Reaktionsschemen zu sprechen ist, welche die chemische Reaktion in Formelschreibweise wiedergeben. Dieser Artikel beschreibt daher diesen grundlegenden Fachbegriff der Chemie und die entsprechende Formelsprache fachwissenschaftlich näher, während im Artikel Reaktionsschema die Regeln erläutert werden, nach denen in der Formelsprache der Chemie ein solches Reaktionsschema (eine solche Reaktions- bzw. chemische Gleichung) formal korrekt erstellt wird. Weiteres empfehlenswertes Fachwissen
Aufbau einer ReaktionsgleichungDer Aufbau einer Reaktionsgleichung (eines Reaktionsschemas) folgt in der Chemie bestimmten Regeln, deren Anwendung beim Erstellen im Artikel Reaktionsschema ausführlich erläutert wird. Zusammengefasst ist zu sagen: Auf der linken Seite stehen die chemischenSummenformeln der Ausgangsstoffe (Edukte) – auf der rechten die Summenformeln der Produkte. Dazwischen wird ein Reaktionspfeil geschrieben (z. B. Beispielsweise wird die Verbrennung von Methangas (Formel: CH4) in Sauerstoffgas (Formel: 2 O2) zu Kohlenstoffdioxid und Wasser durch die Gleichung beschrieben. In diesem Beispiel sind für Kohlenstoff C je ein Atom (links in CH4 und rechts in CO2), für Wasserstoff H je vier Atome (links in CH4 und rechts je 2 in beiden H2O), sowie für Sauerstoff O ebenfalls je vier Atome (links je zwei in beiden O2 und rechts zwei in CO2 und je eines in beiden H2O) vorhanden. Mögliche Zusatzangaben in ReaktionsgleichungenZur Verdeutlichung werden, sofern nicht für den betrachtenden Fall unerheblich, die Phasen der Reaktanden in Kurzbeschreibung im Reaktionsschema mit angegeben. Über den Pfeil schreibt man gegebenenfalls die Reaktionsbedingungen, wie z.B. das Zuführen von Aktivierungsenergie. Die entstehende oder aufgewendete Reaktionsenergie wird auf die Seite geschrieben, wo sie anfällt bzw. aufgewendet werden muss. Für thermodynamische Berechnungen wird häufig die Reaktionsenthalpie mit angegeben, beispielsweise bei der Reaktionsgleichung der Knallgasreaktion Bei der Bildung von einem Mol flüssigem H2O aus gasförmigen H2 und O2 werden also 286 kJ Energie frei. Hier ist es wesentlich, dass die Phase der an der Reaktion beteiligten Substanzen mitangegeben wird, da bei den Phasenübergängen ebenfalls Energie umgesetzt wird. Die Reaktionswärme ΔH wird üblicherweise bei 25 °C angegeben. Ein positiver Wert von ΔH bezeichnet endotherme Reaktionen, ein negativer Wert exotherme Reaktionen. In der Chemie werden in Reaktionsgleichungen verschiedene Pfeile verwendet, deren Bedeutung genau festgelegt ist:
Erstellen einer ReaktionsgleichungAnhand der Reaktion von Wasserstoffgas (H2) und Sauerstoffgas (O2) zu Wasser (H2O) soll das Erstellen einer Reaktionsgleichung geschildert werden. Deutung erstellenDurch die Beobachtung kann man die Endstoffe für eine Reaktionsgleichung erstellen. Wir wissen, dass ein neuer Stoff entsteht. Dieser Stoff kann nicht Wasserstoff oder Sauerstoff sein. Der neue Stoff muss also eine Verbindung aus einem Wasserstoff und Sauerstoff-Atom sein. Wir haben also: Stöchiometrische Wertigkeiten aufschreibenH2 und O2 haben die Wertigkeit 0, da diese Moleküle nur aus einer Atomsorte bestehen. In HO hat H die Wertigkeit +I und O hat die Wertigkeit −II. Nun müssen wir die Atomzahlen von H und O für das Produkt errechnen. Wir bilden das kleinste gemeinsame Vielfache der Wertigkeiten:
Nun ist die Atomzahl dieses kgV dividiert durch die Wertigkeit des Elements. Für H:
Und für O ist die Atomzahl:
Das Produkt muss also H2O lauten. Zum Nachprüfen schaut man, ob das Molekül insgesamt auf eine Wertigkeit von 0 kommt: Die Reaktionsgleichung lautet nun: Ermitteln der FaktorenIn der letzten Gleichung wären unter den Edukten zwei Wasserstoffatome (1 H2) und zwei Sauerstoffatome (1 O2), im Reaktionsprodukt sind es aber zwei Wasserstoffatome (1 H2) und ein Sauerstoffatom (1 O). Man muss also vor das Reaktionsprodukt eine 2 schreiben:
Nun sind es aber bei den Edukten zwei Wasserstoffatome zu wenig, also muss man vor H2 ebenfalls eine 2 schreiben. Ladungen ausgleichenBei manchen Reaktionsgleichungen muss man nun die Ladungen ergänzen. Wir fügen zur Ausgangsseite H+ oder (OH)− hinzu, damit wir auf beiden Reaktionsgleichungen die gleiche Ladung haben. Beispiel: Ausgangsseite hat die Ladung +1 und Endseite hat die Ladung +2, dann müssen wir hinzufügen. Wenn die Ausgangsseite die Ladung +2 und Endseite die Ladung +1 hat, dann müssen wir hinzufügen. Diese Ionen reagieren dann mit den übrigbleibenden H+ oder (OH)− zu H2O. ErgebnisDie Reaktionsgleichung lautet nun: Weitere GleichungenAn Stelle der Vollschreibweise mit kompletten Summenformeln kann man nicht mitreagierende Kationen oder Anionen auch aus der Reaktionsgleichung herauskürzen. Auf diese Weise erstellte Reaktionsgleichungen lauten z. B.: Nutzen von Reaktionsgleichungen: UmsatzberechnungenUm den Stoffumsatz bei einer Reaktion zu berechnen, wird die Reaktionsgleichung mit Hilfe von Stoffmengen-Angaben in Mol benutzt. Grundlagen dieser Rechenmethode finden sich im Artikel Stöchiometrie (Fachrechnen Chemie). Als Beispiel wird hier kurz die oben beschriebene Reaktionsgleichung der Verbrennung von Methangas genommen. Das Reaktionsschema lautet: Es besagt qualitativ: Methan und Sauerstoff reagieren zu Kohlendioxid und Wasser. Es besagt quantitativ: 1 Mol Methangas und 2 Mol Sauerstoff ergeben 1 Mol Kohlendioxid + 2 Mol Wasserdampf. Da 1 Mol Gas unter Normalbedingungen 22,4 L Raum einnimmt, besagt es auch:
Da 1 Mol C 12 g wiegt, 1 Mol Methan 16 g, 1 Mol Sauerstoff 32 g, 1 Mol Wasser 18 g und 1 Mol Kohlendioxid 44 g, so besagt es auch:
Es liegen also je 80 g Ausgangsstoffe (Edukte) und 80 g Endstoffe (Produkte) vor. Aus je 16 g Methangas (22,4 L) werden 44 g Kohlendioxid. Ähnliche Umsatzberechnungen sind für jede andere chemische Reaktion möglich, deren Reaktionsschema erstellt worden ist. So lassen sich erforderliche Rohstoffmengen oder theoretisch erzielbare Produktmengen (bei 100%iger Ausbeute) über Reaktionsschemen und Molare Massen berechnen. Für die Beispielaufgabe Wie viel Wasserstoff entsteht bei der Reaktion von 1 g Lithium mit Wasser? findet sich ein solches Beispiel im Artikel zur Stöchiometrie. Literatur
|
|
| Dieser Artikel basiert auf dem Artikel Reaktionsgleichung aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





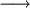 ), der kennzeichnet, in welche Richtung die Reaktion abläuft.
Vor die Formeln setzt man zudem groß geschriebene Zahlen. Diese
), der kennzeichnet, in welche Richtung die Reaktion abläuft.
Vor die Formeln setzt man zudem groß geschriebene Zahlen. Diese 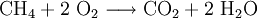
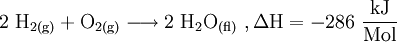
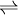 )
)
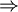 )
)
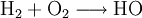
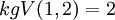 .
.
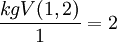 .
.
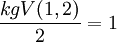 .
.
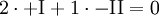
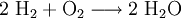
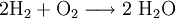 .
.
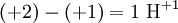
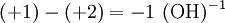
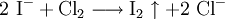
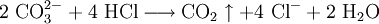
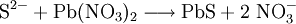
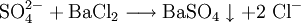
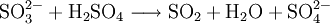
![\mathrm{4 \ Fe^{3+} + 3 \ K_4[Fe(CN)_6] (aq) \longrightarrow Fe_4[Fe(CN)_6]_3 + 12 \ K^+}](images/math/6/1/3/61371152d24377ded02f714e5c2233f9.png)


