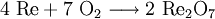Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Rhenium(VII)-oxid
Rhenium(VII)-oxid Re2O7 ist eine chemische Verbindung und zählt zu den Oxiden des Rheniums. Es ist ein gelber hygroskopischer Feststoff. Im Vergleich zum instabilen und explosiven Mangan(VII)-oxid ist Rhenium(VII)-oxid deutlich stabiler. Weiteres empfehlenswertes Fachwissen
Gewinnung und DarstellungRhenium(VII)-oxid entsteht beim Erhitzen von Rhenium oder Rheniumverbindungen an der Luft.
EigenschaftenPhysikalische EigenschaftenRhenium(VII)-oxid kristallisiert in einer orthorhombischen Kristallstruktur mit der Raumgruppe P212121. Die Gitterkonstanten sind a=125 pm, b=152 pm und c=54 pm. Im Kristall bildet Rhenium(VII)-oxid ReO4-Tetraeder und ReO6-Oktaeder, die sich einander abwechseln und über die Ecken verknüpft sind.[2] Chemische EigenschaftenRhenium(VII)-oxid ist sehr hygroskopisch und löst sich gut in Wasser. Beim Lösen bildet sich die starke Säure Perrheniumsäure. VerwendungRhenium(VII)-oxid ist ein Zwischenprodukt bei der Gewinnung von elementarem Rhenium. Es entsteht beim Rösten von rheniumhaltigen Manganerzen. Das Rhenium(VII)-oxid wird nach der Abtrennung vom übrigen Flugstaub in Wasser gelöst. Aus der dabei entstandenen Perrheniumsäure wird das Rhenium als Ammoniumperrhenat ausgefällt und mit Wasserstoff zum Element reduziert. Rhenium(VII)-oxid kann als Katalysator in verschiedenen Reaktionen der organischen Chemie verwendet werden. So können mit Hilfe von Rhenium(VII)-oxid Alkane in Carbonsäuren überführt werden.[3] Weitere durch Rhenium(VII)-oxid katalysierte Reaktionen sind Metathese-Reaktionen von Olefinen.[4] Aus Rhenium(VII)-oxid kann der Katalysator Methyltrioxorhenium (MTO) gewonnen werden.[5] Einzelnachweise
LiteraturHolleman-Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, Berlin 2007. ISBN 978-3-11-017770-1 Kategorien: Brandfördernder Stoff | Ätzender Stoff | Rheniumverbindung | Oxid | Orthorhombisches Kristallsystem |
||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Rhenium(VII)-oxid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||