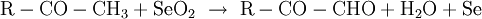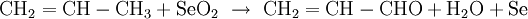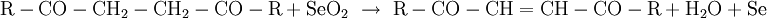Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Riley-OxidationDie Riley-Oxidation ist eine selektive, schonende Oxidation von Ketonen und Alkenen, wobei das zur Oxogruppe oder Doppelbindung α-ständige Kohlenstoffatom mit dem hochgiftigen Selendioxid zum Aldehyd, Keton oder Alken oxidiert wird. Als Lösungsmittel kommen Dioxan, ein Gemisch aus Essigsäure und Essigsäureanhydrid oder Wasser in Frage.[1] Beispiele
Vorteile und Nachteile
Einzelnachweise
Kategorien: Chemische Reaktion | Namensreaktion |
| Dieser Artikel basiert auf dem Artikel Riley-Oxidation aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |