Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Absolute Temperatur
Der Begriff absolute Temperatur, auch thermodynamische Temperatur, bezeichnet einen Temperaturwert, der sich auf den absoluten Nullpunkt bezieht. Er ist ein Grundbegriff der Thermodynamik und der Physikalischen Chemie. Die zugehörige Temperaturskala ist die Kelvin-Skala, in den USA wird auch die Rankine-Skala verwendet. Da der absolute Nullpunkt die tiefst mögliche Temperatur darstellt, die nur theoretisch erreicht werden kann (siehe dritter Hauptsatz der Thermodynamik), stellt die Kelvin-Skala eine absolute Skala dar. Andere Temperaturskalen hingegen beziehen sich stets auf einen Nullpunkt, der willkürlich festgelegt wurde, wie beispielsweise die Celsius-Skala, deren Nullpunkt der Gefrierpunkt von Wasser ist. Weiteres empfehlenswertes Fachwissen
Thermodynamische DefinitionDie Thermodynamische Temperatur eines physikalischen Systems im thermischen Gleichgewicht wird formal mit Hilfe des Wirkungsgrades von Wärmekraftmaschinen definiert. Folgende zwei Forderungen definieren die Thermodynamische Temperatur:
Diese Temperaturdefinition ist universell und substanzunabhängig im folgenden Sinn: Bis auf die Wahl des Temperatur-Referenzpunkts ist sie völlig unabhängig von der chemischen Zusammensetzung der verwendeten Substanzen und von der Bauart der Wärmekraftmaschine, solange diese nur reversibel und periodisch arbeitet. Ein (theoretisches) Beispiel für eine Wärmekraftmaschine, die für diese Temperaturdefinition verwendet werden kann, ist der Carnot-Prozess. Herleitung aus allgemeinen GasgesetzAuch aus dem Verhalten idealer Gase kann auf die absolute Temperatur geschlossen werden. Die absolute Temperatur kann dabei als Grenzwert dargestellt werden: wobei p den Druck, v das Molvolumen und R die Gaskonstante bezeichnet. Der Grenzwert Druck gegen Null zeigen die Gasteilchen keine Wechselwirkung mehr untereinander, was man auch als ein ideales Gas bezeichnet. Logische Konsistenz der TemperaturdefinitionDie logische Konsistenz dieser Temperaturdefinition ist eine Folge des zweiten Hauptsatzes der Thermodynamik. Es gilt nämlich:
Die Temperatur in der Statistischen MechanikEng verwandt mit diesem Begriff der Thermodynamischen Temperatur ist die Temperatur in der Statistischen Mechanik: Ein System der Statistischen Mechanik im thermischen Gleichgewicht bei der Temperatur T wird durch eine Wahrscheinlichkeitsdichte Scheinbare negative WerteAllerdings finden negative absolute Temperaturen als rein rechnerisches Hilfsmittels durchaus Anwendung. So kann man zum Beispiel den Zustand einer Besetzungsinversion mit diesem Hilfsmittel recht einfach beschreiben. Dies ist allerdings nur möglich, da es sich hier um keinen Zustand im thermodynamischen Gleichgewicht handelt. Logarithmische SkalaRudolf Plank schlägt im „Handbuch der Kältetechnik“ alternativ eine logarithmische Temperaturskala vor, bei der keine „tiefst mögliche“ Temperatur auftritt. Der Nullpunkt entspricht dem Schmelzpunkt des Eises. Darunter erstrecken sich die Minusgrade bis minus unendlich. Literatur
|
|||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Absolute_Temperatur aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||





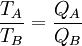
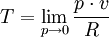
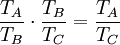
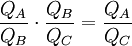
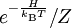 beschrieben. Dabei bezeichnet H die Energiefunktion, also in der Klassischen Physik die Hamilton-Funktion, in der
beschrieben. Dabei bezeichnet H die Energiefunktion, also in der Klassischen Physik die Hamilton-Funktion, in der 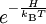 heißt
heißt 

