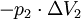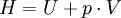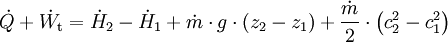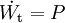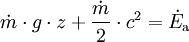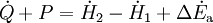Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Thermodynamisches SystemEin thermodynamisches System ist ein räumlich eingegrenzt betrachtetes physikalisches System, für das eine Energiebilanz - beim offenen System zusammen mit einer Stoffbilanz - erstellt werden kann. Beim geschlossenen System werden nur die Energien (Wärme und Arbeit) betrachtet, die über die Systemgrenze fließen und dadurch mit der Änderung der inneren Energie den Zustand des Systems verändern. Weiteres empfehlenswertes Fachwissen
Geschlossenes SystemAls geschlossen wird immer dann ein System bezeichnet, wenn keine Masse die Systemgrenze überschreitet. Wärme und/oder Arbeiten können zu- oder abgeführt werden. Als Arbeiten kommen in Betracht: 1. Die reversibel zugeführte Volumenänderungsarbeit, auch Volumenarbeit genannt. Beispiel in der Skizze: Mit dem Kolben wird reibungsfrei das im Zylinder befindliche Gas verdichtet. Da dV negativ ist, ist also die zugeführte Arbeit positiv. 2. Dissipierte Arbeit. Als Beispiel sei ein Ventilator oder eine elektrische Heizung in einem Raum mit starrer Systemgrenze genannt. Über die Systemgrenze fließt Arbeit (Exergie), die innerhalb des Systems dissipiert wird. Die Arbeit durch Reibungskräfte zwischen Kolben und Zylinder gehört auch zu diesen irreversibel zugeführten Energien. Da nach dem ersten Hauptsatz der Thermodynamik Energie weder erzeugt, noch vernichtet werden kann, erhöht sich die innere Energie um die zugeführten Energien. Die Bilanz für das ruhende geschlossene System lautet: mit (Die Indizes 1 und 2 benennen jeweils den Anfangs- und den Endzustand, der Index 1,2 den Weg von 1 nach 2) Werden durch den Einfluss der zugeführten Energien die äußere Energien des Systems, also die potentielle Energie und/oder die kinetische Energie des Systems verändert, so ist die Bilanz nach dem 1. Hauptsatz für das geschlossene System: Als abgeschlossen bezeichnet man ein geschlossenes System dann, wenn es energiedicht ist (4. Beispiel in der Skizze). Der Idealfall bedarf keiner näheren Betrachtung, da in der Energiebilanz alle Terme verschwinden. Interessant ist die Frage nach einer möglichst guten Wärmeisolation. Offenes SystemWährend Vorgänge am geschlossenen System einmalig ablaufen, erfolgen sie im offenen System meist kontinuierlich. Im stationären Betrieb wird das System von einem konstanten Massenstrom durchflossen. Dabei bleiben die Zustände des Fluids am Eintritt und am Austritt jeweils konstant und das Fluid ändert seinen Zustand auf dem Weg durch das System. Die Wellenarbeit wird beim Verdichten dem System zugeführt, beim Expandieren (Turbine) abgegeben. Man nennt sie Technische Arbeit. Sie wird beschrieben durch: (Hierbei ist δEa die Änderung der äußeren Energien. Die Definition der technischen Arbeit ist in der Literatur unterschiedlich. Verschiedentlich versteht man darunter nur den ersten Term vdp). Neben dieser Arbeit treten am Eintritt und Austritt des Systems Verschiebearbeiten auf. Hat im stationären Betrieb das Masseteilchen Diese Verschiebearbeiten sind neben der inneren Energie U in den jeweiligen Enthalpien enthalten. Mit der Definition der Enthalpie ist die Bilanz für das offene stationäre System: und mit dem Symbol für die Leistung und der äußeren Energie lautet der erste Hauptsatz für die Anwendung am offenen System: Die in der Skizze als Beispiel für ein offenes System gezeigte Verbrennungskraftmaschine ist genau genommen abwechselnd offen und geschlossen. Nur über größere Zeiträume hinweg kann sie als offenes System betrachtet werden. Literatur
Siehe auch |
|
| Dieser Artikel basiert auf dem Artikel Thermodynamisches_System aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





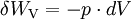

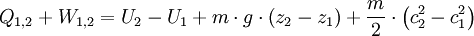
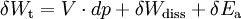
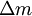 am Eintritt das Volumen
am Eintritt das Volumen 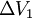 und am Austritt
und am Austritt 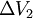 , so ist die Verschiebearbeit am Eintritt
, so ist die Verschiebearbeit am Eintritt
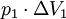 , entsprechend am Austritt
, entsprechend am Austritt