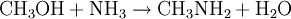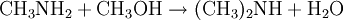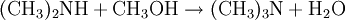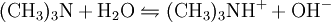Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Trimethylamin
Trimethylamin ist ein farbloses brennbares Gas mit schon in starker Verdünnung intensivem fischartigen Geruch; in höheren Konzentrationen erinnert er stärker an den des chemisch nahe verwandten Ammoniaks. Es ist stark hygroskopisch, löst sich gut in Wasser und bildet darin eine recht starke Base. Es kommt als 40%ige wässrige Lösung und als druckverflüssigtes Gas in den Handel. Weiteres empfehlenswertes Fachwissen
Gewinnung und DarstellungDie großtechnische Herstellung von Trimethylamin erfolgt durch die Umsetzung von Methanol und Ammoniak bei Temperaturen von 370 bis 430 °C und Drücken von 20 bis 30 bar. Die Reaktion wird in der Gasphase an sauren Heterogenkatalysatoren auf der Basis von Silicium-Aluminium-Oxiden durchgeführt. Als Reaktionsprodukte entstehen neben Trimethylamin und Wasser noch Methylamin CH3NH2 und Dimethylamin (CH3)2NH: Die Reinigung und Aufarbeitung des Reaktionsgemisches erfolgt durch mehrstufige Destillation unter Druck. Statt Methanol kann auch Methyliodid als Lieferant der Methylgruppen dienen. Aufgrund der dabei aber recht schnell ablaufenden Reaktion und v.a. des stark sauren Milieu, das die Bildung des quartären Amins überhaupt erst ermöglicht und weil so das während der Reaktion gebildete Trimethylamin weiter umgesetzt wird, ist die Ausbeute an Trimethylamin eher gering. EigenschaftenPhysikalische EigenschaftenBei Raumtemperatur ist Trimethylamin ein farbloses Gas. Es lässt sich durch Abkühlen oder Druckerhöhung verflüssigen. Trimethylamin ist gut löslich in Wasser und aliphatischen Alkoholen wie z.B. Methanol. Es hat einen unangenehmen, fisch- bzw. tran- bis ammoniakartigen Geruch. Es ist schon bei Konzentrationen unter 1 ppb (entsprechend 1 ng/l), deutlich wahrnehmbar und gilt ab dieser Schwelle auch bereits als gesundheitsschädlich.[1] Chemische EigenschaftenTrimethylamin löst sich sehr leicht in Wasser, die Lösung reagiert als Base. Das Molekül dissoziiert in wässeriger Lösung nach: Der höhere pKs-Wert (9,81) gegenüber z.B. Ammoniak (9,25) erklärt sich aus dem +I-Effekt der drei Methylgruppen. Die dennoch schwächere Basizität als die "Zwischenglieder" Methyl- und Dimethylamin (pKs 10,66 bzw. 10,73) lässt sich aus der sterischen Behinderung des freien Elektronenpaares am Stickstoffatom, das für die Basizität verantwortlich ist, erklären. Trimethylamin ist, wie alle Amine, eine schwache Base. Mit Säuren bildet es ionisch aufgebaute Salze, aus denen es mit stärkeren Basen wieder freigesetzt werden kann. Vorkommen in der NaturAls Metabolit des Cholin-Stoffwechsels lässt sich Trimethylamin in vielen Organismen nachweisen. Höhere Konzentrationen entstehen beim mikrobiellen Abbau von Fischeiweiß, beispielsweise durch Bakterien der Gattungen Pseudomonas und Shewanella. Intensiver Trimethylamin-Geruch ("Heringslake") ist deshalb ein sicheres Indiz für mangelnde Frische. Trimethylamin entsteht weiterhin im Vaginalsekret und zersetztem männlichen Ejakulat. Unter den Basidienpilzen sind Brandpilze wie der Steinbrand (Tilletia caries) in der Lage, Trimethylamin zu produzieren und bei Befall von Weizen die Getreidekörner zu verderben. Schließlich produzieren einige Pflanzen Trimethylamin, beispielsweise Stinkender Gänsefuß (Chenopodium vulvaria) und Wald-Bingelkraut (Mercurialis perennis). Auch in den Blüten von Esskastanie, Weißdorn, Birne, Eberesche und weiteren verwandten Rosengewächsen findet sich das Amin. Bei den letztgenannten dient es vermutlich der Anlockung von Käfern als Bestäuber-Insekten (Cantharophilie). Schließlich ist Trimethylamin in Bucheckern enthalten. Abgeleitet vom Gattungsnamen der Rotbuche (Fagus) wird der Stoff deshalb auch als Fagin bezeichnet. Durch Röstung der Früchte wird die Giftwirkung abgebaut. Wirkung auf den menschlichen KörperTrimethylamin gilt als schwach giftig. Es wirkt reizend auf Augen und Atmungsorgane. Bei Geruchswahrnehmung (bereits unter 1 ppb) kann schon eine gesundheitsgefährdende Konzentration vorliegen. Beim Verschlucken können die Wirkungen von Erbrechen mit Bauchschmerzen bis zu Verätzungen führen. Verätzungen können bis hin zur Zerstörung von Haut, Augen, Atem- und Verdauungswegen führen.[1] VerwendungHauptfolgeprodukt von Trimethylamin ist Cholinchlorid, das durch Umsetzung von Ethylenoxid mit einer wässrigen Trimethylaminhydrochlorid-Salzlösung oder durch Umsetzung von Trimethylamin mit 2-Chlorethanol (Ethylenchlorhydrin) hergestellt werden kann. Außerdem findet Trimethylamin Anwendung bei der Herstellung von Wachstumsregulatoren, Ionentauscherharzen und als Katalysator in der organischen Synthese. QuellenKategorien: Feuergefährlicher Stoff | Reizender Stoff | Amin |
||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Trimethylamin aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||