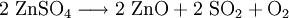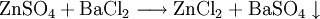Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Zinksulfat
Zinksulfat ist das Zinksalz der Schwefelsäure. Es ist ein weißes, wasserlösliches Pulver. Weiteres empfehlenswertes Fachwissen
Gewinnung und DarstellungEs wird hergestellt durch Auflösen von Zink oder Zinkoxid in verdünnter Schwefelsäure:
Es entsteht durch oxidative Verwitterung von Zinkblende (Zinksulfid, ZnS)
Das so entstandene Mineral ZnSO4 · 7 H2O wird als Goslarit bezeichnet.
EigenschaftenEs zersetzt sich bei Temperaturen oberhalb von 740 °C: Zinksulfat kristallisiert aus seinen wässrigen Lösungen als Zinkvitriol in farblosen, rhombischen Kristallen mit 7 Molekülen Wasser (ZnSO4 · 7 H2O). Es Verliert beim Erhitzen seine Wasseranteile und zerfällt in weißes Pulver. Zinksulfat zeigt in wässriger Lösung infolge teilweiser Hydrolyse schwach saure Reaktion. Bei der Auflösung in Wasser tritt Erwärmung, beim Eindampfen Abkühlung ein.
VerwendungZinksulfat wird in der Färberei, zur Holzimprägnierung und zur Herstellung von Elektrolysezink verwendet. Auf Grund der bakterientötenden Wirkung von Zn2+-Ionen werden sehr verdünnte Lösungen von ZnSO4 (0,1–0,5 %) als Augenwasser bei Bindehautentzündungen eingesetzt.
NachweisNatronlauge (NaOH) gibt mit Zinksulfat einen gallertartigen Niederschlag, der sich im Überschuss des Fällungsmittels wieder löst. Bariumchloridlösung bildet einen weißen Niederschlag von Bariumsulfat:
Quellen
Kategorien: Gesundheitsschädlicher Stoff | Umweltgefährlicher Stoff | Zinkverbindung | Sulfat | Arzneistoff |
||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Zinksulfat aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||







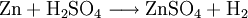
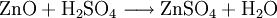
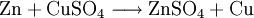 .
.
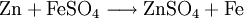 .
.
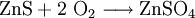 .
.