Bild oder Spiegelbild? Laserlicht entscheidet über Händigkeit von Molekülen
Sieben der zehn häufigsten Medikamente enthalten chirale Wirkstoffe. Das sind Moleküle, die in rechts- oder linkshändiger Form auftreten. Bei der chemischen Synthese entstehen beide Formen meist zu gleichen Teilen und müssen anschließend getrennt werden, weil Händigkeit über die Wirkung im Körper entscheidet. Physikern der Goethe-Universität ist es nun mithilfe von Laserlicht gelungen, gezielt rechts- oder linkshändige Moleküle herzustellen.
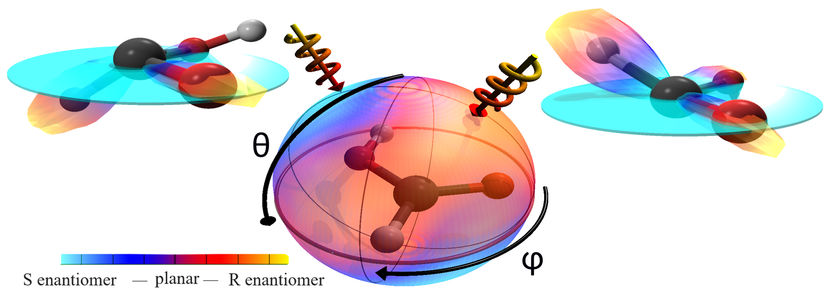
Im Zentrum befindet sich das Modell der Ameisensäure. Der Farb-Code der ihr umgebenden Sphäre zeigt die mittlere Händigkeit der Ameisensäure für jede Richtung aus welcher der Laser kommt. Schießt man von der rechten Seite (rechter Pfeil), so erhält man die rechtshändige Ameisensäure, von der linken Seite, die Linkshändige Ameisensäure. Die beiden chiralen Ameisensäuren spiegeln die gemessene Struktur der Moleküle wider.
Goethe-Universität Frankfurt am Main
„Für die Pharmazie wäre es ein Traum, wenn man statt mit nasser Chemie ein Molekül mit Licht von einer in die andere Händigkeit überführen könnte“, erklärt Prof. Reinhard Dörner vom Institut für Kernphysik der Goethe-Universität. Sein Doktorand Kilian Fehre ist der Realisierung dieses Traumes nun einen entscheidenden Schritt nähergekommen. Seine Beobachtung: Je nachdem, aus welcher Richtung Laserlicht auf das Ausgangsmolekül trifft, entsteht die rechts- oder linkshändige Variante.
Für sein Experiment verwendete Kilian Fehre ein planares Molekül, die Ameisensäure. Dieses regte er mit einem intensiven, zirkular polarisierten Laserpuls an, um es in eine chirale Form zu überführen. Gleichzeitig zerbrach das Molekül durch die Bestrahlung in seine atomaren Bestandteile. Die Zerstörung des Moleküls war für das Experiment notwendig, um überprüfen zu können, ob die Bild- oder Spiegelbild-Variante entstanden war.
Für die Analyse verwendete Fehre das am Institut für Kernphysik entwickelte „Reaktionsmikroskop“ (COLTRIMS-Methode). Damit kann man einzelne Moleküle in einem Molekülstrahl untersuchen. Nach der explosionsartigen Zerlegung des Moleküls misst der Detektor mit hoher Genauigkeit, aus welcher Richtung und mit welcher Geschwindigkeit die Fragmente ankommen. So lässt sich die räumliche Struktur des Moleküls rekonstruieren.
Um künftig chirale Moleküle mit der gewünschten Händigkeit selektiv herstellen zu können, wird man gewährleisten müssen, dass die Moleküle im Verhältnis zum zirkular polarisierten Laserstrahl gleich orientiert ist. Das könnte man erreichen, indem man sie vorher mit einem langwelligen Laserlicht räumlich ausrichtet.
Die Erkenntnis könnte auch für die Herstellung größerer Mengen von Molekülen mit einheitlicher Händigkeit eine Schlüsselrolle spielen. Hier jedoch, vermuten die Forscher, würde man eher Flüssigkeiten als Gase mit Laserlicht bestrahlen. „Bis dahin jedoch ist noch viel Arbeit zu tun“, schätzt Kilian Fehre.
Nachweis und Manipulation chiraler Moleküle mittels Licht ist das Thema eines von der Deutschen Forschungsgemeinschaft seit 2018 geförderten Sonderforschungsbereiches mit dem griffigen Namen „ELCH“, zu dem sich Wissenschaftler aus Kassel, Marburg, Hamburg und Frankfurt zusammengeschlossen haben. „Diese langfristige Förderung und die enge Zusammenarbeit in dem Sonderforschungsbereich gibt uns den langen Atem, um in Zukunft Chiralität in einer großen Klasse von Molekülen steuern zu lernen“, freut sich Markus Schöffler, einer der Frankfurter Projektleiter des Sonderforschungsbereiches.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Synthese
Die chemische Synthese steht im Zentrum der modernen Chemie und ermöglicht die gezielte Herstellung von Molekülen mit spezifischen Eigenschaften. Durch das Zusammenführen von Ausgangsstoffen in definierten Reaktionsbedingungen können Chemiker eine breite Palette von Verbindungen erstellen, von einfachen Molekülen bis hin zu komplexen Wirkstoffen.

Themenwelt Synthese
Die chemische Synthese steht im Zentrum der modernen Chemie und ermöglicht die gezielte Herstellung von Molekülen mit spezifischen Eigenschaften. Durch das Zusammenführen von Ausgangsstoffen in definierten Reaktionsbedingungen können Chemiker eine breite Palette von Verbindungen erstellen, von einfachen Molekülen bis hin zu komplexen Wirkstoffen.