Lösliche Elemente aus einer neuen Ecke des Periodensystems
Die Welt der Chemie ist um eine Premiere reicher: Eine Forschungsgruppe der Universität Würzburg präsentiert die ersten löslichen und stabilen Varianten eines elementaren s-Block-Elements. Normalerweise sind diese Elemente hoch reaktiv.
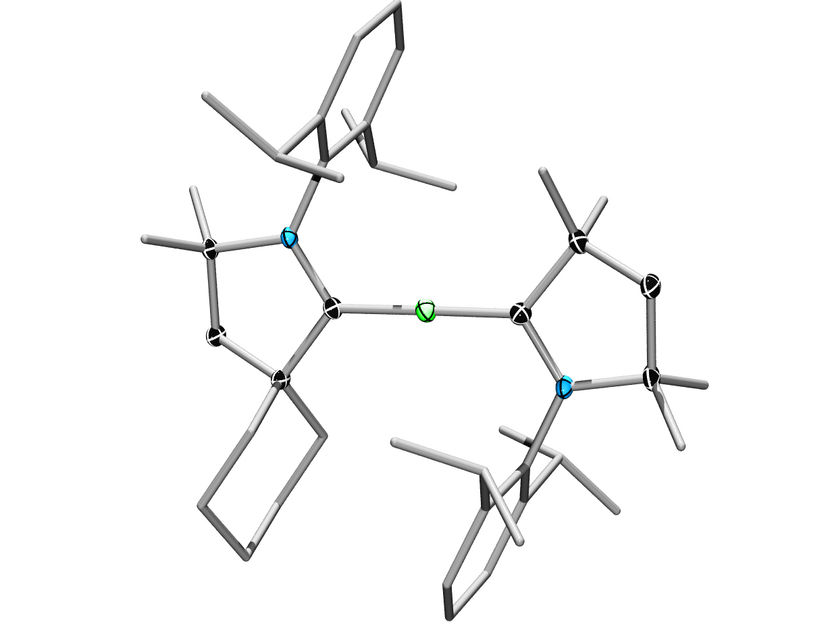
Beryllium in der Mitte, flankiert von zwei stabilisierenden ringförmigen Liganden: So sieht eine weitere „Weltpremiere“ aus der Würzburger Chemie aus.
Julia Schuster
Viele Schüler kennen es aus dem Chemie-Unterricht: Wenn reines Natrium mit Wasser in Kontakt kommt, fängt es an zu brennen und explodiert. Denn Natrium will partout nicht in seinem elementaren Zustand bleiben und ist darum hoch reaktiv. Das gilt auch für alle anderen Metalle aus dem sogenannten s-Block der Elemente, zu dem das Natrium gehört.
Eine Chemie-Forschungsgruppe der Julius-Maximilians-Universität Würzburg hat es jetzt erstmals geschafft, eines der „wilden“ Metalle aus diesem Block zu bändigen: Sie hat es in seinem elementaren Zustand in Moleküle eingebaut, ohne dass ein großer Knall oder der sofortige Zerfall die Folge ist. Das Metall ist Beryllium, stabilisiert wird es von zwei ringförmigen Liganden.
Diese Premiere aus dem Team von Professor Holger Braunschweig ist hochrangig publiziert, nämlich im Fachjournal Nature Chemistry. Das liegt zum einen daran, dass die neuen Moleküle so ungewöhnlich stabil sind. Zum anderen könnten diese Ergebnisse aus den Würzburger Chemielabors eine neue Ära für die Chemie der s-Block-Metalle einläuten.
Aussichtsreiche Kandidaten für anspruchsvolle Reaktionen
Zu den anspruchsvollsten und in der chemischen Industrie oft durchgeführten Reaktionen gehört die Übertragung von Wasserstoff und Kohlenstoffmonoxid auf organische Moleküle. Derzeit laufen solche Reaktionen ausschließlich mit Hilfe von schweren Übergangsmetallen wie Rhodium, Platin und Palladium ab. Aus Nachhaltigkeits- und Kostengründen wäre es darum nicht nur der Industrie willkommen, wenn es Alternativen aus den Reihen der Hauptgruppenelemente gäbe, die in der Erdkruste zudem reichlich vorhanden sind.
Dafür müssen diese Elemente allerdings zuerst in ihren Elementarzustand gebracht werden – ein Unterfangen, das alles andere als trivial ist. Denn elementare Hauptgruppenelemente, zu denen auch das Natrium gehört, sind überaus reaktiv. Erste Erfolge wurden hier schon bei einigen p-Block-Elementen wie Silicium, Zinn und Bor erzielt. Nun wurde auch das erste elementare s-Block-Metall, Beryllium, auf diese Weise gebändigt.
Alternativen zum toxischen Beryllium entwickeln
„Der einzige Nachteil an Beryllium ist die Toxizität“, sagt Dr. Merle Arrowsmith, Postdoc und Alexander-von-Humboldt-Stipendiatin in der Gruppe von Holger Braunschweig. Viel spannender seien darum andere s-Block-Elemente wie Magnesium und Kalzium. Sie sind auf der Erde nicht nur im Überfluss vorhanden, sondern auch biokompatibel und zudem als Katalysatoren für viele wichtige Reaktionen geeignet.
Wenn sich mit elementarem Beryllium stabile Moleküle herstellen lassen, stehen die Chancen sehr gut, dass das auch mit anderen s-Block-Metallen klappen kann. „Uns ist hier ein erster Vorstoß geglückt, die s-Block-Elemente in einen Zustand zu bringen, in dem sie Reaktionen bewältigen können, die sonst den kostbaren Schwermetallen vorbehalten sind“, sagt Chemikerin Julia Schuster, die die neuen Moleküle synthetisiert hat. Als nächstes will die Arbeitsgruppe ähnliche Methoden für weitere s-Block-Elemente entwickeln.
Originalveröffentlichung
Merle Arrowsmith, Holger Braunschweig, Mehmet Ali Celik, Theresa Dellermann, Rian D. Dewhurst, William C. Ewing, Kai Hammond, Thomas Kramer, Ivo Krummenacher, Jan Mies, Krzysztof Radacki, Julia K. Schuster; "Neutral zero-valent s-block complexes with strong multiple bonding“; Nature Chemistry; Advance Online Publication 6. Juni 2016.