Verbesserte Fähigkeit zur Kontrolle chemischer Reaktionen
Die Entdeckung bietet einen Vorgeschmack auf die "verbotene Frucht" der Reaktionsdynamik
Wissenschaftler der University of Toronto haben einen Weg gefunden, das Ergebnis der chemischen Reaktion zu bestimmen, indem sie einen schwer fassbaren und lang gesuchten Faktor verwenden, der als Stoßparameter bekannt ist.
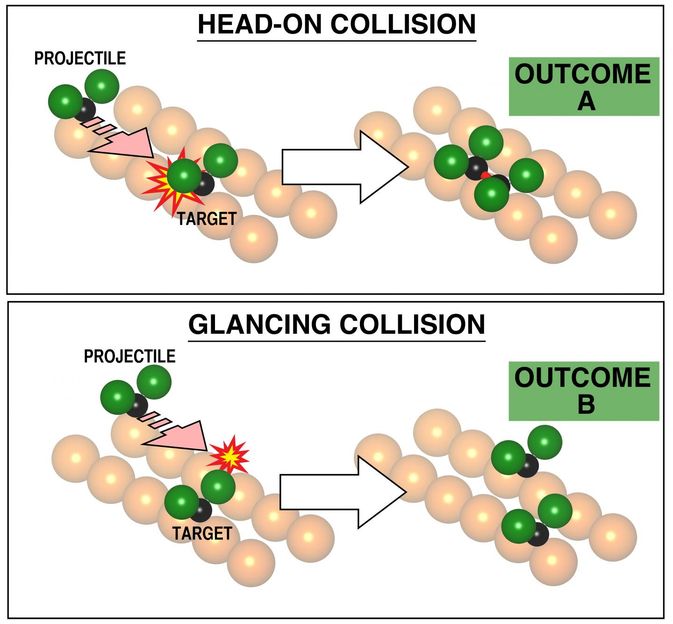
Die Auswahl der Stoßparameter ist entscheidend für das Ergebnis der chemischen Reaktion, wie sie hier anhand von Experimenten visualisiert wird. Bei einer direkten Kollision ergab die Reaktion (oben) reproduzierbar die Bildung eines gebundenen Paares von CF2-Molekülen an der Kupferoberfläche. Im zweiten Fall, im unteren Teil, einer Kollision bei etwas höherem Stoßparameter (3,6 Angström statt Null), sind die rechts im Bild gezeigten Produkte jeweils weit auseinander, separat chemisch an das darunterliegende Metall gebunden. Auch dies ist eine chemische Reaktion, die jedoch ein anderes Reaktionsmuster mit dem Metall aufweist. Der Stoßparameter wird gesehen, um den Reaktionsweg zu bestimmen. Dies wurde bisher nicht nachgewiesen, da es nicht möglich war, den Stoßparameter auszuwählen.
Kelvin Anggara & Lydie Leung/University of Toronto
Das Team von U of T-Chemikern unter der Leitung des Nobelpreisträgers John Polanyi hat ein Mittel gefunden, um den Stoßparameter oder die Entfernung auszuwählen, um die ein Reagenzmolekül ein Zielmolekül verfehlt und dadurch die Produkte der chemischen Reaktion verändert.
"Chemiker schleudern ständig Moleküle an andere Moleküle, in der Hoffnung, etwas Neues zu schaffen", sagt Polanyi, Universitätsprofessor am Department of Chemistry an der U of T. "In dieser Studie haben wir einen Weg gefunden, das Ergebnis zu kontrollieren, indem wir ein Projektilmolekül auf ein Zielmolekül gerichtet haben, mit einer Genauigkeit von einem kleinen Bruchteil des Durchmessers des Zielmoleküls."
Die Molekulardynamik in der Chemie ist ähnlich wie ein Billardspiel. So wie ein Billardspieler den ankommenden Ball zum Zielball schickt, starten Chemiker ein Molekül zum anderen, um eine chemische Reaktion zu erzeugen. Dies kann klassisch, durch Zufall, oder in einem kontrollierten Rahmen geschehen.
Bisher hat die inhärente Zufälligkeit der Molekularbewegungen verhindert, dass Chemiker ihre Projektilmoleküle auf die chemischen Ziele richten, wie es Billardspieler tun. Stattdessen waren sie gezwungen, ihr Billardspiel mit verbundenen Augen zu spielen.
"Im Laufe der Jahre sind Chemiker sehr gut darin geworden, Billard mit verbundenen Augen zu spielen, klebrige Kugeln zu benutzen und sie stark oder schwach zu schleudern", sagt Polanyi. "Aber wir haben einen Weg gefunden, die Augenbinde abzunehmen und jeden Schuss zu fokussieren."
Die Forscher erreichten dies, indem sie Moleküle auf einem Metallkristall absetzten und dann einen kleinen Strom von einer atomar scharfen Metallspitze auf eines der Moleküle anlegen. Diese Energiezufuhr veranlasste ein "Projektil"-Molekül, in gerader Linie über die Oberfläche zu fliegen, entlang eines der schienenartigen Grate auf dem Metallkristall, zu einem nahen "Ziel"-Molekül auf dem Kristall.
Verschiedene Fehlabstände, die als Stoßparameter bezeichnet werden, wurden reproduzierbar dargestellt, um unterschiedliche Ergebnisse, d.h. unterschiedliche Reaktionsmuster, zu erhalten.
"Die darunter liegende kristalline Oberfläche ist unser Billardtisch", sagt Kelvin Anggara, Postdoc in Polanyis Forschungsgruppe und Hauptautor der Studie. "Indem wir die Rillen ausnutzten, die die Natur bequem über die Oberfläche von Kristallen gekerbt hat, fanden wir heraus, dass wir das wandernde Molekularprojektil so führen konnten, dass es das Ziel entweder frontal oder bei einer streifenden Kollision traf, die das Ziel um einen gewünschten Wert verfehlte. Auf diese Weise können wir, genau wie im Billard, den Ausgang der molekularen Kollision kontrollieren."
Die Auswahl des Fehlabstands- oder Stoßparameters bei Kollisionen zwischen Reagenzmolekülen wurde bisher vom Harvard University Professor Dudley R. Herschbach, mit dem Polanyi 1986 zusammen mit Yuan T. Lee den Nobelpreis für Chemie erhielt, als "verbotene Frucht der Reaktionsdynamik" bezeichnet. Während die Entdeckungen des Trios es den Chemikern ermöglichten, viele der Kräfte, die bei einer chemischen Reaktion wirken, abzuleiten, hat sich der Stoßparameter der direkten Kontrolle entzogen.
Dies gilt auch unter den bekannt gut kontrollierten Bedingungen von "gekreuzten Molekularstrahlen". Es wird oft übersehen, dass die Strahlen bei dieser eleganten Methode zwar aufeinander gerichtet sind, die Moleküle aber nicht. Nun können die einzelnen Moleküle ganz präzise aufeinander ausgerichtet werden.
"Wir glauben, dass dies ein großer Fortschritt in der Kontrolle chemischer Reaktionen ist", sagte Anggara, die die Studie zusammen mit Polanyi, der Senior Research Associate Lydie Leung und dem Doktoranden Matthew Timm durchführte.