Chemische Hotspots
Rastertunnelmikroskop-Messungen zeigen aktive Zentren auf Katalysatoroberflächen
Chemie live: Mit einem Rastertunnelmikroskop konnten Forscher an der Technischen Universität München (TUM) erstmals die Aktivität von Katalysatoren während einer chemischen Reaktion detailgenau verfolgen. Die Messungen zeigen, wie die Oberflächenstruktur der Katalysatoren ihre Aktivität beeinflusst. Die neue Analysemethode lässt sich nun nutzen, um Katalysatoren für die elektrochemische Industrie zu verbessern.

Die Auswertung des Tunnelstroms eines Rastersondenmikroskops zeigt die aktiven Zentren eines Katalysators.
Christoph Hohmann / NIM

Jonas Pfisterer und Yunchang Liang am Rastertunnel-Mikroskop im Labor der Arbeitsgruppe von Prof. Bandarenka, Professur für Physik der Energiewandlung und -speicherung der TU München.München. (Bild: )
Wenzel Schürmann / TUM


Ohne Katalysatoren keine Energiewende: Die chemischen Prozesse, die notwendig sind, um mit Strom Wasserstoffgas herzustellen, den Wasserstoff in Brennstoffzellen wieder in elektrische Energie zu verwandeln, oder Kohlendioxid in Treibstoff umzuwandeln, würden viel zu langsam ablaufen. Katalysatoren beschleunigen die Reaktionen, ohne dabei verbraucht zu werden.
„Katalysatoren sind für die Industrie enorm wichtig. Diese hat daher großes Interesse daran, die Materialien weiter zu verbessern, um die Effizienz der Prozesse zu erhöhen“, sagt Aliaksandr Bandarenka, Professor für Physik der Energiewandlung und -speicherung an der TUM.
Eine wichtige Voraussetzung dafür hat der Chemiker jetzt zusammen mit seinem Team geschaffen: Erstmals ist es gelungen, mit einem Rastertunnelmikroskop die Oberfläche von Katalysatoren während eines chemischen Prozesses zu untersuchen.
Auf diese Weise konnte detailgenau ermittelt werden, an welchen Stellen die Reaktionsgeschwindigkeit und damit die Aktivität der Katalysatoren am höchsten ist. Diese Ergebnisse sind nun in der Fachzeitschrift „Nature“ erschienen.
Den aktiven Zentren auf der Spur
Schon seit langem erforschen Wissenschaftler die Zusammenhänge zwischen der Oberflächenstruktur und der Aktivität heterogener Katalysatoren, bei denen chemische Reaktionen an der Grenzfläche zwischen Feststoff und Flüssigkeit beziehungsweise Gas stattfinden. Heterogene Katalysatoren werden beispielsweise bei der elektrolytischen Gewinnung von Wasserstoffgas oder bei der Reinigung von Autoabgasen eingesetzt.
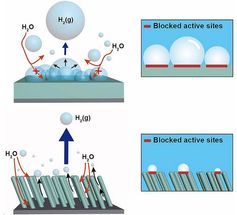
„Die chemischen Reaktionen laufen jedoch nicht überall gleich schnell ab, sondern es gibt auf der Oberfläche der Katalysatoren aktive Zentren“, berichtet Bandarenka. „Um diese zu lokalisieren, waren wir bisher auf Modellrechnungen und indirekte Messungen angewiesen.“
Mit dem neuen Analyseverfahren lassen sich die aktiven Zentren jetzt erstmals experimentell nachweisen. Proben mit Katalysatormaterialen – darunter Platin und eine Kombination aus Gold und Palladium – werden dazu mit einer flüssigen Elektrolytschicht bedeckt und im Rastertunnelmikroskop untersucht.
Während Wasserstoffionen, also Protonen, aus dem Elektrolyt an der Oberfläche des Katalysators Elektronen aufnehmen und Wasserstoffgas bilden, rastert die Spitze des Mikroskops im Abstand nun nur wenigen Nanometern die Katalysatoroberfläche ab. Punkt für Punkt wird nun der „Tunnelstrom“ gemessen, der zwischen Oberfläche und Spitze fließt. Ein angeschlossener Rechner registriert die Signale.
Das Geheimnis des Rauschens
„Interessanterweise sind die Tunnelströme nicht überall gleich. Da gibt es Bereiche, in denen der Strom stärker, aber unregelmäßig fließt – er rauscht“, berichtet Bandarenka. Dieses Rauschen sei seit längerem bekannt, doch bisher habe niemand nach den Ursachen gefragt.
Bei der Auswertung der Daten stieß das TUM-Team jetzt auf einen eindeutigen Zusammenhang zwischen der Intensität des Rauschens und Defekten an der Oberfläche der Katalysatoren – mikroskopisch feinen Stufen, Kanten oder Ecken. „Mit der Zahl der Defekte nimmt das Rauschen zu – es fließen mehr Elektronen und damit mehr Strom“, erläutert Banderenka.
Das Fast-Food-Prinzip
Das Verhalten der Ionen vergleicht der Wissenschaftler mit dem von Gästen eines Fast-Food-Restaurants: Wenn diese nur ungemütliche Sitzgelegenheiten vorfinden, gehen sie gleich wieder hinaus ohne etwas zu konsumieren. Sind die Stühle hingegen sehr bequem, bleiben sie lange sitzen und blockieren den Platz, so dass keine neuen Gäste mehr hinzukommen. Nur wenn die Sitzgelegenheiten nicht zu bequem und nicht zu ungemütlich sind, kommen die Kunden, essen und gehen wieder.
Übertragen auf die chemischen Prozesse bei der Elektrolyse heißt das: Ist die Oberfläche des Katalysators für die Wasserstoffionen chemisch zu anziehend oder zu abstoßend, kommt die Reaktion zum Erliegen. Am effektivsten ist sie dort, wo Ionen hinzogen werden, aber nicht zu lange verweilen.
Weniger Nachbarn machen reaktionsfreudig
Kleine Defekte im Atomgitter, aber auch Grenzen zwischen Materialien – beispielsweise Palladium auf Gold – scheinen solche idealen Bedingungen für die Katalyse zu schaffen. Doch warum? „Unsere Experimente zeigen, dass die Zahl der Nachbaratome und die daraus resultierende Stärke der Bindung entscheidend ist für die Aktivität“, erläutert Oliver Schneider, einer der Mitautoren der Publikation.
Die Ergebnisse wollen die TUM-Forscher jetzt nutzen, um effektivere Katalysatormaterialien mit möglichst großen aktiven Bereichen zu entwickeln.