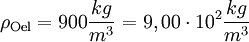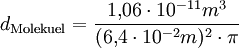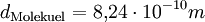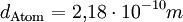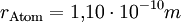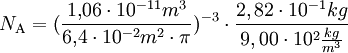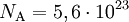Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
ÖlfleckversuchDer Ölfleckversuch ist ein Versuch aus der Chemie und Physik, der es mit einfachen Mitteln möglich macht, sowohl die Größe eines Atoms als auch die Avogadrozahl näherungsweise zu bestimmen. Weiteres empfehlenswertes Fachwissen
VersuchsaufbauAuf eine mit Wasser gefüllte Schale wird eine feine Schicht Bärlappsporen gepudert. Diese dienen dazu, die Wasseroberfläche besser sichtbar zu machen. Anschließend wird ein Tropfen eines Gemischs aus Ölsäure und Petrolether oder Leichtbenzin mit bekannter Konzentration und zuvor bestimmtem Volumen in die Mitte der Schale gegeben. Die chemische Formel der Ölsäure muss ebenfalls bekannt sein. Der Petrolether oder das Leichtbenzin dienen der Verdünnung der Ölsäure, die sich so besser in sehr kleinen Mengen dosieren lässt, und einer gleichmäßigen schnellen Verteilung der Ölsäure auf dem Wasser. Der Petrolether oder das Leichtbenzin verdunstet sofort, weshalb auf dem Wasser ein Fleck aus reiner Ölsäure entsteht. Dieser verdrängt die Bärlappsporen kreisförmig an den Rand der Schale, weshalb er deutlich sichtbar ist und mit einem Lineal vermessen werden kann. Im Idealfall entsteht ein perfekter Kreis, meist „zerfranst“ aber der Rand. AuswertungVon grundlegender Bedeutung ist die Annahme, dass es sich bei dem Ölfleck um eine monomolekulare Schicht handelt, das heißt, dass sich nicht mehrere Moleküle übereinander befinden. Dies kann man durch einfache Zusatzversuche belegen. Gibt man einen weiteren, gleich großen Öltropfen hinzu, verdoppelt sich der Flächeninhalt genau. Zudem ist es nicht möglich, den Fleck zu vergrößern, etwa durch blasen. Berechnung der MolekülgrößeEinen möglichst runden Fleck kann man nun als Zylinder betrachten, wobei der Durchmesser eines Moleküls der Höhe des Zylinders entspricht. Über das Volumen des Tropfens und die Konzentration der Petrolether(Benzin)-Ölsäure kann man nun das Volumen der reinen Ölsäure ausrechnen, das mit dem des Zylinders identisch ist. Mit dem abgemessenen Radius kann man nun die Höhe des Zylinders berechnen. Dadurch hat man bereits die Größe eines Ölsäuremoleküls. Berechnung der AtomgrößeIn der einfachsten Form der Berechnung geht man von würfelförmigen Molekülen und Atomen aus. Da man nun die Kantenlänge kennt, kann man wiederum das Volumen eines Moleküls berechnen. Aus der chemischen Formel der Ölsäure kann man erkennen, aus wie vielen Atomen ein Molekül besteht. Man geht nun davon aus, dass alle Atome gleich groß sind und das Volumen des Moleküls vollständig ausfüllen. Teilt man also das Volumen eines Moleküls durch die Anzahl der Atome, erhält man das Volumen eines Atoms. Da man wieder eine Würfelform verwendet, kann man den Durchmesser eines Atoms berechnen. Je nach Genauigkeit der Durchführung erhält man einen Atomradius von etwa 10 − 10 Metern, angesichts der Einfachheit des Versuchs ein sehr genauer Wert. Berechnung der AvogadrozahlDa man nun die Kantenlänge eines Moleküls kennt, kann man die Anzahl an Molekülen im Ölfleck ausrechnen, indem man das Volumen des Öls durch das Volumen eines Moleküls dividiert. Über die Definition der Avogadrozahl weiß man, dass sich die Anzahl der Moleküle des Ölflecks zur Avogadrozahl so verhält wie die Masse des Öls im Ölfleck zu der Masse eines Mols Öl (Molare Masse oder Molmasse), welche man aus der chemischen Formel und den Angaben des Periodensystems entnehmen kann. Auch das Ergebnis der Avogadrozahl liegt in der richtigen Größenordnung, je nach Versuch etwa zwischen Mathematischer AnsatzKlärung der FormelzeichenBekannte oder gemessene Größen:
Zwischenergebnisse:
Gesuchte Größen:
Benötigte mathematische Formeln
Berechnung der Molekülgröße
Berechnung der Atomgröße
Berechnung der Avogadrozahl
ZahlenbeispielBekannte Größen
Molare Masse der ÖlsaureDie Masse eines Kohlenstoffatoms beträgt 12 u, die eines Sauerstoffatoms 16 u und die eines Wasserstoffatoms 1 u. Aus der Formel der Ölsäure C17H33COOH erkennt man, dass ein Molekül aus 18 Kohlenstoff-, 2 Sauerstoff- und 34 Wasserstoffatomen besteht. Die Molekülmasse beträgt damit 282 u, womit die Molare Masse der Ölsäure 282 g bzw. 0,282 kg beträgt. Rechnung
|
|
| Dieser Artikel basiert auf dem Artikel Ölfleckversuch aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





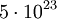 und
und 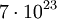 . Der exakte Wert beträgt
. Der exakte Wert beträgt 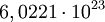 .
.
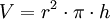 (Volumen eines Zylinders)
(Volumen eines Zylinders)
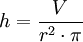 (Aufgelöst nach h)
(Aufgelöst nach h)
![a = \sqrt[3]{V}](images/math/a/3/c/a3cad8c35c7c4e9e2f0ea5afff93ab52.png) (Aufgelöst nach a)
(Aufgelöst nach a)
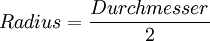
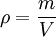
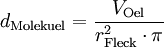
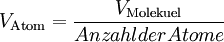
![d_{\mathrm{Atom}} = \sqrt[3]{ \frac{ d_{\mathrm{Molekuel}}^3}{Anzahl der Atome}}](images/math/e/c/1/ec1c8b4fb693e1f877c6876e15dca3a5.png)
![r_{\mathrm{Atom}} = \frac{\sqrt[3]{ \frac{(\frac{V_{\mathrm{Oel}}}{r_{\mathrm{Fleck}}^2 \cdot \pi})^3}{Anzahl der Atome}}}{2}](images/math/5/4/2/54262e8ce8ecc435e90f810508e80ea0.png)
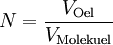
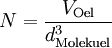
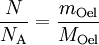
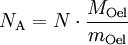
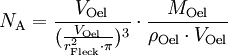
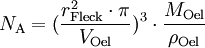
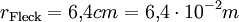
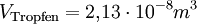
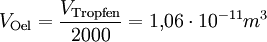 (da Mischungsverhältnis 1 : 2000)
(da Mischungsverhältnis 1 : 2000)