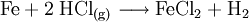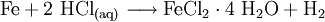Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Eisen(II)-chlorid
Eisen(II)-chlorid (FeCl2) ist eine chemische Verbindung von Eisen(II)- und Chlorid-Ionen. Die römische Ziffer II gibt die Oxidationszahl des Eisenions (in diesem Fall +2) an. Eisen(II)-chlorid gehört zur Gruppe der Eisenhalogenide. Weiteres empfehlenswertes FachwissenUnter die Bezeichnung Eisenchlorid fällt auch die Verbindung Eisen(III)-chlorid (FeCl3). Gewinnung und DarstellungEisen(II)-chlorid wird durch Reaktion von Eisen mit trockenem Chlorwasserstoffgas hergestellt. Dagegen kann man wasserfreies Eisen(II)-chlorid nicht durch Auflösen von Eisen in Salzsäure und anschließende Fällung erzeugen. Dabei entsteht das wasserhaltige Eisen(II)-chlorid-Tetrahydrat FeCl2 · 4 H2O und molekularer Wasserstoff: Außerdem entsteht es als Nebenprodukt bei der Herstellung von Titandioxid nach dem Chloridverfahren. Beim Beizen von Eisenblechen und -teilen, als vorbereitendem Schritt der Verzinkung, fallen große Mengen an. VerwendungIm Labor und in der Synthesechemie ist es ein wichtiger Ausgangsstoff zur Herstellung von weiteren Eisenverbindungen wie Eisen(III)-chlorid. Bei der Abwasserreinigung dient es als Fäll- und Flockungsmittel. So verwenden beispielsweise Kläranlagen häufig Eisen(II)-chlorid zur Phosphatelimination, das heißt zur Ausfällung von Phosphaten (Waschmittel- bzw Spülmittelbestandteile). Beste Ergebnisse werden bei der Simultanfällung erreicht. Bei langen Abwasserkanalstrecken und Abwasserdruckleitungen kommt es in den wärmeren Jahreszeiten immer wieder zu Geruchsproblemen. Ursache ist die Bildung von Schwefelwasserstoff. Die Bildung von Schwefelwasserstoff kann mit Eisen(II)-chlorid verhindert werden. Biogasanlagen haben ebenfalls mit der Bildung von Schwefelwasserstoff zu kämpfen. Hier wird Eisen(II)-chlorid zur Biogasentschwefelung eingesetzt. Neben der festen Form wird Eisen(II)-chlorid als wässrige Lösung im gummierten Tankwagen oder in Kannen vom Chemiehandel ausgeliefert. Seit kurzem findet die Verbindung auch Verwendung in der Raumfahrt. QuellenKategorien: Gesundheitsschädlicher Stoff | Eisenverbindung | Chlorid | Arzneistoff |
||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Eisen(II)-chlorid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||