Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Säure-Base-ReaktionSäure-Base-Reaktionen sind chemische Reaktionen, bei denen Wasserstoff-Kationen H+ (d.h. meist nur Protonen) zwischen Molekülen oder Molekül-Ionen ausgetauscht werden. Weil bei diesem Reaktionstyp ein Teilchen ein Proton "ablöst", das von einem anderen Teilchen aufgenommen wird, nennt man diese Reaktion auch Protolyse. Nach Brønsted wird das Teilchen, das das Proton abgibt, als Brønsted-Säure oder Protonendonator bezeichnet. Das Teilchen, welches das Proton empfängt, heißt Brønsted-Base oder Protonenakzeptor. Stellt man eine Brønsted-Säure durch das Symbol HA dar und eine Brønsted-Base durch B, so lässt sich eine Säure-Base-Reaktion nach Brønsted wie folgt formulieren: 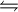 A- + HB+ A- + HB+Weiteres empfehlenswertes FachwissenBeispiel: In diesem Beispiel gibt HCl ein H+ ab und wird damit zu Cl-. Das freie H+ wird von H2O aufgenommen, das damit zu H3O+ wird. Bei einer Säure-Base-Titration wird eine abgemessene saure oder basische Probelösung aus einer Bürette mit einer Maßlösung bekannter Konzentration versetzt, um die unbekannte Konzentration der Probelösung zu bestimmen. Ein sprunghafter Anstieg der Titrationskurve oder ein Farbumschlag des Indikators zeigt das Erreichen des Äquivalenz- bzw. Endpunktes der Titration an. Siehe hierzu auch: |
| Dieser Artikel basiert auf dem Artikel Säure-Base-Reaktion aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |







