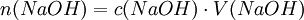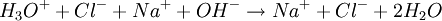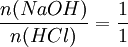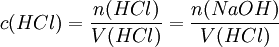Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Säure-Base-Titration
Das Ziel einer Säure-Base-Titration ist es, die Stoffmengenkonzentration c in mol/l einer Säure bzw. Base unbekannter Konzentration zu bestimmen. Man nutzt dabei die Idee, dass sich eine saure und eine basische Lösung bei einem bestimmten Mengenverhältnis vollständig neutralisieren. Der pH-Wert der Lösung geht dabei gegen 7. Wird eine Säure mit einer Base bekannter Konzentration (Maßlösung) titriert, nennt man dieses Verfahren auch Alkalimetrie. Im umgekehrten Fall, Titration einer Base mit einer Säure, spricht man von Acidimetrie. Beispiel: Es wird zu Salzsäure unbekannter Konzentration aus einer Bürette Natronlauge mit bekannter Konzentration hinzugetropft. Aufgrund der Menge der eingesetzten Salzsäurelösung und verbrauchten Menge an Natronlauge kann unter Zuhilfenahme der Reaktionsgleichung die Konzentration der Salzsäure bestimmt werden. Um den Äquivalenzpunkt (vollständige Neutralisation von Säure und Base) der Titration festzustellen, gibt es verschiedene Möglichkeiten. Weiteres empfehlenswertes Fachwissen
Titration mit einem IndikatorTitration einer einprotonigen Säure, am Beispiel von Salzsäure mit Natronlauge und Methylorange als IndikatorMit einer Pipette werden 25 ml der Salzsäure-Lösung in einen 100-ml-Erlenmeyerkolben (zumeist ein Weithalserlenmeyerkolben) gegeben. Man verdünnt die Lösung mit destilliertem Wasser auf 100 ml. Man gibt 2–3 Tropfen des Indikators Methylorange hinzu. Eine Bürette wird bis knapp über die oberste Marke mit Natronlauge der Konzentration c = 1 mol/l gefüllt. Büretten haben häufig an der Hinterseite einen blauen Streifen (Schellbach-Streifen)[1] [2]. An der Stelle, an der er sich verjüngt, ist das Flüssigkeitsniveau abzulesen. Man muss die Bürette genau auf 0 ml einstellen (Überschuss in ein Becherglas abfließen lassen). Durch einen Rührfisch kann man die Durchmischung der Lösung gewährleisten. Der Erlenmeyerkolben mit der Lösung unbekannter Konzentration wird unter die Bürette auf ein weißes Blatt gestellt um einen Farbumschlag rechtzeitig zu bemerken. Nun lässt man die Natronlauge langsam, tropfenweise in die Säure-Lösung hineinlaufen. Nach einiger Zeit färbt sich der Indikator zunächst nur kurzzeitig an der Stelle, an der die Tropfen eintauchen. Gegen Ende der Titration währt der Farbumschlag des Methylorange immer länger. Wenn dies der Fall ist, gibt man die Natronlauge nur noch in einzelnen Tropfen zu. Der pH-Wert ist erreicht, wenn der Indikator seinen vollen Farbumschlag zeigt. Damit ist der Äquivalenzpunkt und damit das Ende der Titration erreicht. Nun kann man den Verbrauch der Natronlauge an der Bürette ablesen und durch folgende Rechnung die Konzentration der Salzsäure-Lösung bestimmen. Die Stoffmenge n der eingesetzten Natronlauge ergibt sich aus der Molarität c und dem Volumen V Die Reaktionsgleichung der Neutralisation lautet: Daraus folgt: Salzsäure reagiert mit Natronlauge im Stoffmengenverhältnis eins zu eins: Die Konzentration der Salzsäure lässt sich nun aus der bekannten Stoffmenge und dem verwendeten Volumen errechnen: Wahl des IndikatorsDie Wahl des Indikators hängt von der verwendeten Säure und Base ab. Der Farbumschlag des Indikators sollte immer möglichst dicht im Äquivalenzpunkt liegen. Für das Beispiel der Titration von Salzsäure mit Natronlauge (starke Säure mit starker Base) eignet sich der Indikator Bromthymolblau, da seine Farbe etwa bei einem pH-Wert von 7 umschlägt, welches genau dem Äquivalenzpunkt der Neutralisationsreaktion von Salzsäure mit Natronlauge entspricht. Soll man dagegen die Konzentration von schwachen Säuren, wie Essigsäure und Ameisensäure mit Hilfe von Natronlauge bestimmen, so verwendet man zum Beispiel den Indikator Phenolphthalein, dessen Umschlagspunkt von farblos nach rot-lila etwa bei dem pH-Wert von 10 liegt. Das ist nötig, da eine Lösung von gleichen Mengen an Essigsäure und Natronlauge leicht alkalisch reagiert. Genauigkeit der Titration mit IndikatorBei der Endpunktsbestimmung gibt es einige Unsicherheiten. Vor allem die Feststellung des Umschlagpunktes des Indikators bringt eine große Ungenauigkeit mit sich, abhängig vom Farbumschlag (abrupt oder sehr schleichend, deutlich unterschiedene Farben oder ähnliche Farbe...) des Indikators. Durch geschickte Wahl des passenden Indikators bzw. einer Kombination mehrerer Indikatoren kann man die Konzentration jedoch meist sehr genau bestimmen. Auch die Erfahrung spielt eine große Rolle. So gibt/gab es durchaus Methoden, einen "persönlichen Faktor" zu bestimmen, mit dem der Analysewert korrigiert wurde. Titration mit einer pH-ElektrodeMan kann den Endpunkt der Titration auch mit Hilfe einer pH-Elektrode, also mit einem elektrischen Messgerät bestimmen. Diese Messmethode ergibt ein eindeutiges Ergebnis, das nicht von der Erfahrung des Ausführenden abhängt. Es entfällt dann natürlich der Einsatz eines Indikators. Da insbesondere die mehrwertigen Säuren sog. Pufferkapazitäten haben, bei denen der pH-Wert relativ lange während der Titration konstant bleibt und der Neutralpunkt ziemlich plötzlich erreicht werden kann, lässt sich dieses Verhalten mit einem pH-Gerät besser beobachten. Automatische TitrationEine Weiterentwicklung der Titration mit dem pH-Meter führt dazu, dass nicht nur der pH-Wert elektronisch durch einen Computer erfasst wird, sondern auch die Zugabe der Titrationsflüssigkeit automatisch geregelt werden kann. Ferner kann der an die Titrationsapparatur angeschlossene Computer die Ergebnisse gleich weiterverarbeiten und z. B. in einen Konzentrationswert umrechnen. Damit ist die Titration vollständig automatisierbar. Siehe auch: Laborautomatisierung Quellen
Kategorien: Chemisches Analyseverfahren | Säure-Base-Reaktion |
|
| Dieser Artikel basiert auf dem Artikel Säure-Base-Titration aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |