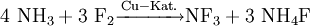Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Stickstoff(III)-fluorid
Stickstoff(III)-fluorid ist eine chemische Verbindung die zur Gruppe der Stickstoffhalogenide gehört. Weiteres empfehlenswertes Fachwissen
GeschichteStickstoff(III)-fluorid wurde 1928 von Otto Ruff (1971-1939) erstmals durch Elektrolyse von wasserfreiem Ammoniumhydrogenfluorid (NH4HF2) dargestellt[2]. Im Jahre 1957 gelang es Peter Sartori das Verfahren wesentlich sicherer zu machen, indem er die als Nebenprodukte entstehenden instabilen und explosiven Fluoramin NH2F und Difluoramin NHF2 durch bei der Reaktion eingebrachtes Braunstein eliminierte[3]. Gewinnung und DarstellungEs kann durch Umsetzung von Fluor mit Ammoniak oder durch Elektrolyse geschmolzenen Ammoniumhydrogenfluorids hergestellt werden:[4] EigenschaftenChemische EigenschaftenStickstoff(III)-fluorid reagiert bei Raumtemperatur nicht mit Wasser und besitzt im Gegensatz zu Ammoniak nahezu keine basischen Eigenschaften. Es ist ein starkes Oxidationsmittel. VerwendungStickstoff(III)-fluorid wird in der Halbleiter-Industrie zum Plasmaätzen, zum Ätzen von Silicium und Siliciumnitrid, Wolfram-Silizium-Verbindungen und Wolfram-Schichten sowie zum Reinigen von CVD-Kammern verwendet. Weiterhin wird es als Brennstoff in chemisch getriebenen Fluorwasserstoff-Lasern (z.B. MIRACL[5]), als Oxydator von einigen Raketentreibstoffen und zur Herstellung von Tetrafluorhydrazin (N2F4) eingesetzt. SicherheitshinweiseStickstoff(III)-fluorid ist nach EG-Richtlinien als brandfördernd und gesundheitsschädlich klassifiziert. Es zersetzt sich beim Erhitzen und reagiert heftig mit einigen organischen Verbindungen (z.B. brennbaren Stoffen). Quellen
Kategorien: Brandfördernder Stoff | Gesundheitsschädlicher Stoff | Stickstoffverbindung | Fluorverbindung |
||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Stickstoff(III)-fluorid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||