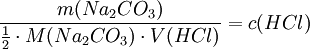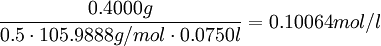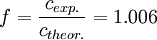Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Titer (Chemie)Der Titer oder Normalfaktor f in der analytischen Chemie ist ein Faktor, der die Abweichung der tatsächlichen Konzentration einer Maßlösung von der Nennkonzentration der Lösung angibt. Weiteres empfehlenswertes Fachwissen
Daraus ergibt sich bei der Titration mit der eingestellten Lösung
Der Titer ist ein für die jeweilige Maßlösung spezifischer Wert. Je nach Bestimmungsmethode kann ein leicht unterschiedlicher Titer für ein und dieselbe Maßlösung bestimmt werden. Eine bekannte Methode zur Titerbestimmung ist die Säure-Base-Titration oder Redox-Titration, aber auch gravimetrische oder argentometrische Bestimmungen sind möglich. Sinnvollerweise wird die gleiche Methode für die Messung und die Titer-Bestimmung verwendet, da die Endpunkt-Bestimmung bei jeder Methode unterschiedlich ist und so Differenzen entstehen. Je nach verwendeter Messmethode zur Titerbestimmung ist eine geeignete Urtitersubstanz zu wählen. Dazu wird die zu bestimmende Maßlösung mit einer Urtitersubstanz, deren Stoffmenge genau bekannt ist, titriert. Aus dem Volumen der zugesetzten Maßlösung und der eingesetzten Stoffmenge der Urtitersubstanz kann mithilfe der Reaktionsgleichung die exakte Konzentration der Maßlösung bestimmt werden.
Beispiel für die Bestimmung des Titers einer Salzsäurelösung (c~0.1mol/L)Als Urtitersubstanz wird Natriumcarbonat gewählt, das mit Salzsäure wie folgt reagiert:
Aus der Reaktionsgleichung ist ersichtlich, dass die halbe Stoffmenge Natriumcarbonat der verbrauchten Stoffmenge Salzsäure entspricht. Es wird eine bestimmte Menge Natriumcarbonat, das aus einer gesättigten Lösung mit Kohlendioxid ausgefällt, gewaschen und bis zur Massenkonstanz getrocknet wurde, möglichst genau abgewogen, in Wasser gelöst und mit einem Indikator wie Methylorange versetzt. Nun wird bis zum Umschlagpunkt titriert. Aus dem Verbrauch an Maßlösung und der eingesetzten Stoffmenge an Natriumcarbonat kann die Konzentration der Salzsäurelösung bestimmt werden. Vorlage: m(Na2CO3) = 0.4000g (~3.77 mmol); c(HCL) = ca. 0.1 mol/l Stöchiometrie:
Die Salzsäurelösung hat also eine tatsächliche Konzentration von 0.1006 mol/l. Um den Titer zu errechnen, teilt man nun die gemessene tatsächliche Konzentration durch die Nennkonzentration und erhält:
Einige Maßlösungen sind so instabil, dass der Titer bei jeder Verwendung der Maßlösung neu ermittelt werden muss. Dies gilt besonders für niedrig konzentrierte Lösungen von Iod, Salzsäure, Natronlauge und Kaliumpermanganat; Iod und Chlorwasserstoff verdampfen aus der Lösung, Natriumhydroxid bildet mit dem Kohlendioxid der Luft Natriumcarbonat und Kaliumpermanganat zersetzt sich in einem autokatalytischen Prozess zu Braunstein. Einigermaßen stabil sind höherkonzentrierte Maßlösungen von Salz- und Schwefelsäure, Natriumthiosulfat, Cer(IV), Kaliumdichromat, Silbernitrat (unter Lichtausschluss) und natürlich Urtitermaßlösungen. Aber auch diese Maßlösungen müssen mindestens einmal pro Monat geprüft werden. Das Arzneibuch, die Rechtsvorschrift für die Analytik in der Apotheke und der Pharmazeutischen Industrie schreibt vor, dass der Titer maximal um 10 % abweichen darf, also einen Wert zwischen 0,9 und 1,1 haben muss, da sonst bei Gehaltsbestimmungen Probleme auftreten können. |
| Dieser Artikel basiert auf dem Artikel Titer_(Chemie) aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





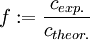
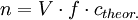
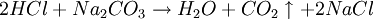
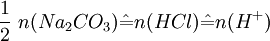
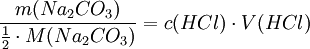 (gemäß Beispiel: 2 * 3.77 mmol = 7.5 mmol)
(gemäß Beispiel: 2 * 3.77 mmol = 7.5 mmol)