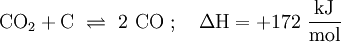Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Boudouard-Gleichgewicht
Das Boudouard-Gleichgewicht ist das nach Octave Leopold Boudouard (1872–1923) benannte Gleichgewicht zwischen Kohlenstoffdioxid (CO2) und Kohlenstoffmonoxid (CO), das sich bei der Umsetzung von Kohlenstoffdioxid mit glühendem Kohlenstoff einstellt. Hohe Temperaturen verschieben das Gleichgewicht aufgrund der endothermen Reaktion auf die Produktseite (CO), eine Erhöhung des Drucks verschiebt es auf die Seite der Ausgangsstoffe (auch bekannt als Edukte), da die Anzahl der gasförmigen Moleküle dadurch abnimmt. (Siehe dazu auch das Prinzip von Le Chatelier und Braun: Prinzip vom kleinsten Zwang). Produkt-HighlightReaktion: Die Reaktion wird bei der Erzeugung von Generatorgas angewandt. Siehe auchKategorien: Anorganische Chemie | Thermodynamik |
||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Boudouard-Gleichgewicht aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||